
【题目】下列说法错误的是( )
A.化学反应中的能量变化都表现为热量变化
B.需要加热才能发生的反应不一定是吸热反应
C.向醋酸钠溶液中滴入酚酞试液,加热后若溶液红色加深,则说明盐类水解是吸热的
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】CO2是重要的化工原料,也是应用广发的化工产品.CO2与过氧化钠或超氧化钾反应可产生氧气.
完成下列计算:
(1)CO2通入氨水生成NH4HCO3 , NH4HCO3很容易分解.2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为L(标准状况).
(2)某H2中含有2.40molCO2 , 该混合气体通入2.00L NaOH溶液中,CO2被完全吸收.如果NaOH完全反应,该NaOH溶液的浓度为 .
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2
4KO2+4CO2+2H2O→4KHCO3+3O2
若9mol CO2在密封舱内和KO2反应后生成9mol O2 , 则反应前密封舱内H2O的量应该是多少?列式计算.
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O ![]() CO+3H2 , 已知:CO+2H2
CO+3H2 , 已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O。300mol CH4完全反应后的产物中,加入100mol CO2后合成甲醇.若获得甲醇350mol,残留氢气120mol,计算CO2的转化率.
CH3OH+H2O。300mol CH4完全反应后的产物中,加入100mol CO2后合成甲醇.若获得甲醇350mol,残留氢气120mol,计算CO2的转化率.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物.(反应条件图中已省略) 
(1)A,B,C,D代表的物质分别为、、、(填化学式).
(2)反应①中的C、D均过量,该反应的化学方程式是 .
(3)反应④的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面提到的问题中,与盐的水解无关的是
A.明矾和FeCl3可作净水剂
B.为保存FeCl3溶液,要在溶液中加少量盐酸
C.用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
D.氢氟酸用塑料试剂瓶保存而不用玻璃试剂瓶保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫铁矿(主要成分FeS2)生产硫酸和绿矾(FeSO47H2O)的工业流程示意图如图: 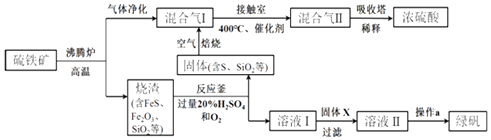
(1)沸腾炉中,硫铁矿进行粉碎处理的目的是 .
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是 .
(3)反应釜中,烧渣经过反应转化为溶液I和固体.
①烧渣中的FeS在反应中做剂(填“氧化”或“还原”).
②溶液I中所含溶质的化学式是 .
(4)操作a的主要步骤是:加热浓缩、、过滤洗涤.
(5)流程中,固体X可以选择硫铁矿(FeS2)或;当固体X为硫铁矿(FeS2)时,将溶液I与固体X发生反应的离子方程式补充完整:
FeS2++═Fe2++SO42﹣+ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应X(g)+Y(g)2Z(g),在容积为2L 的密闭容器中反应,有关物质的物质的量的变化如图所示.下列叙述正确的是( ) 
A.a为1.60
B.X和Y的转化率相等
C.0~10min的平均速率V(Z)=0.079molL﹣1min﹣1
D.容器内Z的浓度最大可以达到1.00 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是恒温下某反应的化学反应速率随反应时间变化的示意图.下列叙述与示意图不相符合的是( ) 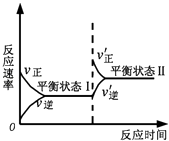
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ
C.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
D.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 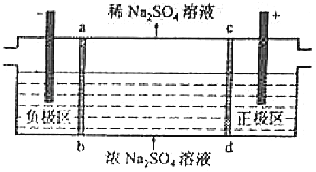
A.通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com