
 我国部分城市灰霾天占全年一半.引起灰霾的PM2.5微细粒子包含(NH4)2S04、NH4N03、有机颗粒物及扬尘等.通过测定灰霾中锌等重金属的含量,可知交通污染是目前造成我国灰霾天气主要原因之一.
我国部分城市灰霾天占全年一半.引起灰霾的PM2.5微细粒子包含(NH4)2S04、NH4N03、有机颗粒物及扬尘等.通过测定灰霾中锌等重金属的含量,可知交通污染是目前造成我国灰霾天气主要原因之一.分析 (1)Zn元素是30号元素,Zn原子形成离子先失去高能层中的电子,结合核外电子排布规律书写;
(2)根据价层电子对互斥模型判断粒子的空间结构;
(3)①a.N20与CO2是等电子体,结构相似;
b.同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族;
c.CH2=CH-CHO分子中每个碳原子均形成三根共价键,均采用sp2杂化;
d.HCOOH分子间能形成氢键;CH30CH3不能形成分子间氢键;
②1molHCOOH中含σ键数目为4mol;
③配位体位于方括号中,由1个NO和5个H20分子构成;
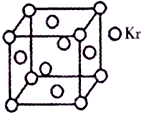
(4)以顶点为计算,与之相邻的最近的Kr位于三个面心上,而顶点的原子为8个立方体共有,每个面心上的Kr为两个立方体共有,故与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,然后求出比值.
解答 解:(1)Zn元素是30号元素,Zn原子的核外电子排布式为1s22s22p63s23p63d104s2,故Zn2+的基态电子排布式为1s22s22p63s23p63d10,
故答案为:1s22s22p63s23p63d10;
(2)SO42-中中心原子S的价层电子对为$\frac{6+2}{2}$=4,杂化方式为SP3杂化,所以其空间构型为正四面体结构,
故答案为:正四面体;
(3)①a.N20与CO2是等电子体,CO2的结构式O=C=O,所以N20结构式可表示为N=N=O,故a正确;
b.同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,由于氮原子是半满结构更稳定,所以其第一电离能大小顺序是:N>O>C,故b错误;
c.CH2=CH-CHO分子中每个碳原子均形成三根共价键,均采用sp2杂化,故c正确;
d.HCOOH分子间能形成氢键;CH30CH3不能形成分子间氢键,所以相同压强下,HCOOH沸点比CH30CH3高,故d错误;
故选:ac;
②1molHCOOH中含有3个单键,1个双键,共有4个σ键,含σ键数目为4mol,故答案为:4mol;
③配位体位于方括号中,由1个NO和5个H20分子构成,则配位数位6,
故答案为:NO和H20;
(4)与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含Kr原子为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则$\frac{m}{n}$=$\frac{4}{12}$=$\frac{1}{3}$,
故答案为$\frac{1}{3}$.
点评 本题是道综合题,涉及的知识点有电子排布式、分子空间构型、等电子体的运用、化学键、配合物、晶体中粒子数目的计算等知识,易错点为(4).


科目:高中化学 来源: 题型:选择题
| A. | O2和O3互为同位素 | B. | 1个15O2中含有18个中子 | ||
| C. | 18O2与16O2的性质完全相同 | D. | 16O和18O的核外电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHS溶液中通入Cl2:S2-+Cl2═S↓+2Cl- | |
| B. | NaN02溶液中滴加酸性KMnO4溶液:5NO2-+2MnO4-+3H2O═5NO3-+2Mn2++6OH- | |
| C. | NH4HSO4溶液中滴加少量的Ba(OH)2溶液:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O | |
| D. | 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+═2Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
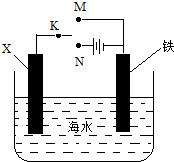
| A. | 若X为碳棒,为减缓铁的腐蚀,开关K应置于N处 | |
| B. | 若X为碳棒,开关K置于M处,会加快铁的腐蚀 | |
| C. | 若X为锌,开关K置于M处,就是牺牲阳极的阴极保护法 | |
| D. | 若X为锌,开关K置于N处,铁电极发生的反应为Fe-2e-═Fe${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和CO都是酸性氧化物,都能与水反应 | |
| B. | Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同 | |
| C. | Al2O3和Na2O按物质的量比1:1投入水中可得到澄清溶液 | |
| D. | 金属铝排在金属活动性顺序表中氢元素的前面,铝与强酸反应一定放出氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com