
高铁酸钾(K2FeO4)具有很强的氧化性,是一种新型的高效水处理剂。
(1)高铁酸钾具有强氧化性的原因是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ,___ _____。
(3)制备K2FeO4可以采用干式氧化法或湿式氧化法。
① 干式氧化的初始反应是2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中每生成2 mol Na2FeO4时转移电子 mol。
② 湿式氧化法的流程如下图:
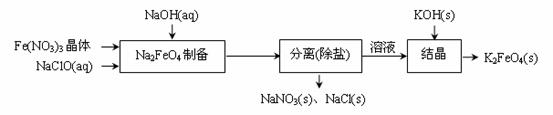
上述流程中制备Na2FeO4的化学方程式是 。
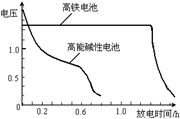
(4)高铁电池是正在研制中的可充电电池,右图为该电池和常用的高能
碱性电池的放电曲线,由此可得出的高铁电池的优点有 、
。
(5)探究高铁酸钾的某种性质。
【实验1】将适量K2FeO4固体分别溶解于pH 为 4.74、7.00、11.50 的水溶液中,配得FeO42-浓度为 1.0 mmol·L-1(1 mmol·L—1 =10—3 mol·L—1)的试样,静置,考察不同初始 pH 的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。
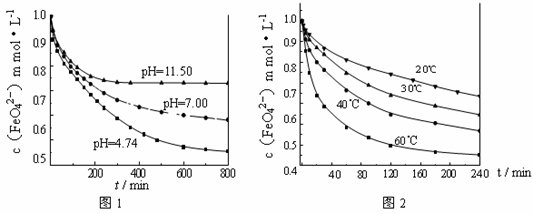
【实验2】将适量 K2FeO4 溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为
1.0 mmol·L-1 的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是 ;
②实验2可得出的结论是 ;
③高铁酸钾在水中的反应为4 FeO42—+10 H2O 4 Fe(OH)3 +8OH—+3 O2↑。 由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是
4 Fe(OH)3 +8OH—+3 O2↑。 由图1可知,800 min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是
。
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.NA表示阿伏加德罗常数,1 mol Na被完全氧化生成Na2O2,失去2NA个电子
(2013·广东理综,9D)
B.Na2O2用作呼吸面具的供氧剂涉及氧化还原反应 (2012·广东理综,10A)
C.小苏打的主要成分是碳酸钠 (2012·海南,2B)
D.NaHCO3的热稳定性大于Na2CO3 (2012·重庆理综,7B)
查看答案和解析>>
科目:高中化学 来源: 题型:
在①丙烯(CH2=CH—CH3);②氯乙烯;③苯;④甲苯(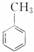 )四种有机物中,分子内所有原子均在同一平面的是 ( )。
)四种有机物中,分子内所有原子均在同一平面的是 ( )。
A.①② B.②③ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A的结构简式为:
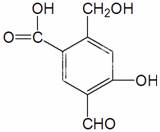
(1)A与过量的NaOH溶液反应时,A与参加反应的NaOH的物质的量之比是 。
(2)A与新制Cu(OH)2反应时, A与被还原的Cu(OH)2的物质的量之比是 。1molA最多能消耗 mol Cu(OH)2。
(3)A与过量的NaHCO3反应时,A与NaHCO3的物质的量之比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z是三种常见元素的单质,甲乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是
A.X、Y、Z都是非金属单质
B.如果X、Y都为非金属单质,则Z必为金属单质
C.如果X、Y都为金属单质,则Z必为非金属单质
D.X、Y、Z中至少有一种是金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)____HCl(浓)+____MnO2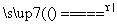 ____Cl2↑+____MnCl2+____H2O
____Cl2↑+____MnCl2+____H2O
(2)____Cu+____HNO3(稀)===____Cu(NO3)2+____NO↑+____H2O
(3)____KI+____KIO3+____H2SO4===____I2+____K2SO4+____H2O
(4)____MnO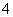 +____H++____Cl-===____Mn2++____Cl2↑+____H2O
+____H++____Cl-===____Mn2++____Cl2↑+____H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O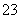 +O2+xOH-===Fe3O4↓+S4O
+O2+xOH-===Fe3O4↓+S4O +2H2O。请回答下列问题。
+2H2O。请回答下列问题。
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是____________。
(2)反应的化学方程式中x=____ ____。
____。
(3)每生成1 mol Fe3O4,反应转移的电子为________mol,被Fe2+还原的O2的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
0.02 mol KMnO4固体加热一段时间后,收集到a mol甲气体,在反应后的残留固体中加入足量的浓盐酸,继续加热,又收集到b mol乙气体,设此时Mn元素全部以Mn2+存在于溶液中,则下列说法正确的是 ( )
A.甲、乙均为无色无味的气体
B.a的最大值为0.02
C.b的最小值为0.01
D.a+b的 最小值为0.04
最小值为0.04
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.苯和乙烯都能使溴水退色,其褪色原理是相同的
B.所有烷烃和蛋白质分子中都存在碳碳单键
C.人们通常用聚乙烯、聚氯乙烯塑料来制食品包装袋,它们都是高分子化合物
D.乙醇可以转化成乙酸,乙醇和乙酸都能发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com