
����Ŀ��H2��һ����Ҫ�������Դ��
��1����֪��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H2=-49.0kJmol-1
CH3OH(g)+H2O(g) ��H2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H3=-41.1kJmol-1
CO2(g)+H2(g) ��H3=-41.1kJmol-1
H2��ԭ CO��Ӧ�ϳɼ״����Ȼ�ѧ����ʽΪ��CO(g)+2H2(g)![]() CH3OH(g) ��H1������H1��___kJmol-1���÷�Ӧ�Է����е�����Ϊ___
CH3OH(g) ��H1������H1��___kJmol-1���÷�Ӧ�Է����е�����Ϊ___
A������ B������ C���κ��¶�������
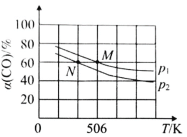
��2�����º�ѹ�£����ݻ��ɱ���ܱ������м��� 1molCO��2.2mol H2��������ӦCO(g)+2H2(g)![]() CH3OH(g)��ʵ����ƽ��ʱCO��ת�������¶ȡ�ѹǿ�ı仯��ͼ��ʾ����P1__P2���жϵ�������_____��
CH3OH(g)��ʵ����ƽ��ʱCO��ת�������¶ȡ�ѹǿ�ı仯��ͼ��ʾ����P1__P2���жϵ�������_____��
��3������Ӧ CO(g)+2H2(g)![]() CH3OH(g)���¶Ȳ���������㶨Ϊ1���ܱ������з�������Ӧ�����и����ʵ����ʵ�����ʱ��仯�����ʾ��
CH3OH(g)���¶Ȳ���������㶨Ϊ1���ܱ������з�������Ӧ�����и����ʵ����ʵ�����ʱ��仯�����ʾ��
ʱ��/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
�����и�������Ϊ�жϸ÷�Ӧ�ﵽƽ���־����____(����ĸ)��
C������������Է����������ֲ��� D�����������ܶȱ��ֲ���
������ʼѹǿΪP0 kPa�����ڸ��¶��·�Ӧ��ƽ�ⳣ��Kp=___(kPa)-2����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
�۷�Ӧ�������õ�λʱ���ڷ�ѹ�ı仯��ʾ����10min��H2�ķ�Ӧ����v(H2)=___kPamin-1��
���𰸡�-90.1 B > ����ӦΪ�����������С�ķ�Ӧ����ѹƽ�����ƣ�CO��ת����������ͼ֪��ͬ�¶�ʱP1��CO��ת���ʴ���P2 AC 9/p02 P0/30
��������
��1�����ݸ�˹��������֪����CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ��H2=-49.0kJmol-1����CO(g)+H2O(g)
CH3OH(g)+H2O(g) ��H2=-49.0kJmol-1����CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H3=-41.1kJmol-1����+�ڵã�CO(g)+2H2(g)
CO2(g)+H2(g) ��H3=-41.1kJmol-1����+�ڵã�CO(g)+2H2(g)![]() CH3OH(g) ��H1=(-49.0kJmol-1)+( -41.1kJmol-1)= -90.1 kJmol-1,���Դ˷�ӦΪ���ȷ�Ӧ���÷�Ӧ���µ��������Է����У���B��ȷ���𰸣� -90.1�� B��
CH3OH(g) ��H1=(-49.0kJmol-1)+( -41.1kJmol-1)= -90.1 kJmol-1,���Դ˷�ӦΪ���ȷ�Ӧ���÷�Ӧ���µ��������Է����У���B��ȷ���𰸣� -90.1�� B��
��2����ӦCO(g)+2H2(g)![]() CH3OH(g) ������Ӧ�����������С�ķ�Ӧ����������������ʱ������ѹǿ����ѧƽ�������ƶ���CO��ƽ��ת����������ͼʾ��֪��COת����P1>P2������ѹǿ��P1>P2���𰸣�>;����ӦΪ�����������С�ķ�Ӧ����ѹƽ�����ƣ�CO��ת����������ͼ֪��ͬ�¶�ʱP1��CO��ת���ʴ���P2 ��
CH3OH(g) ������Ӧ�����������С�ķ�Ӧ����������������ʱ������ѹǿ����ѧƽ�������ƶ���CO��ƽ��ת����������ͼʾ��֪��COת����P1>P2������ѹǿ��P1>P2���𰸣�>;����ӦΪ�����������С�ķ�Ӧ����ѹƽ�����ƣ�CO��ת����������ͼ֪��ͬ�¶�ʱP1��CO��ת���ʴ���P2 ��
��3����A����Ϊ��Ӧ CO(g)+2H2(g)![]() CH3OH(g)�������������ȵķ�Ӧ�����¶Ȳ���������㶨Ϊ1���ܱ������У���������ѹǿ���ֲ��� ��˵����Ӧ�ﵽƽ���ˣ���A��Ϊ�жϸ÷�Ӧ�ﵽƽ���־����A��ȷ��
CH3OH(g)�������������ȵķ�Ӧ�����¶Ȳ���������㶨Ϊ1���ܱ������У���������ѹǿ���ֲ��� ��˵����Ӧ�ﵽƽ���ˣ���A��Ϊ�жϸ÷�Ӧ�ﵽƽ���־����A��ȷ��
B����v��(H2)=2v��(CH3OH) ʱ������֤����Ӧ�ﵽƽ��״̬�ˣ�����B����Ϊ�жϸ÷�Ӧ�ﵽƽ���־����B����
C������������Է���������ֵ�ϵ���ƽ��Ħ���������͵������������������ʵ�������Ϊ�����ʶ������壬�������������䣬��ѧ��Ӧ�����������ȣ����Ե�ƽ��Ħ���������ֲ��䣬˵����Ӧ�ﵽ��ƽ��״̬����C��ȷ��
D�����������ܶ���=m/V,��Ϊm��V���ֲ��䣬���������䣬����ܶȲ��䣬����Ϊ�жϸ÷�Ӧ�ﵽƽ���־����D����
���Ա���𰸣�AC��
���ݷ�ӦCO(g)+2H2(g)![]() CH3OH(g)�����е����ݿ�֪10minʱ���ﵽƽ�⣬������ʵ���Ϊ��Ϊ��
CH3OH(g)�����е����ݿ�֪10minʱ���ﵽƽ�⣬������ʵ���Ϊ��Ϊ��
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
��ʼ�� 2 4 0
�仯�� 1 2 1
ƽ���� 1 2 1
���ݰ���٤�����ɣ�����ʼѹǿΪP0 kPa����ƽ��ѹǿΪ2/3P0������ƽ�ⳣ��Kp= = (2/3P0��1/4)/[2/3P0��1/4��(2/3P0��1/2)2]= 9/p02,�𰸣�9/p02��
= (2/3P0��1/4)/[2/3P0��1/4��(2/3P0��1/2)2]= 9/p02,�𰸣�9/p02��
�۸���ͼ����֪������ʼѹǿΪ2/3P0��10min��ƽ��ѹǿΪ1/3P0����H2�ķ�Ӧ����v(H2)= 1/3P0��10min =1/30 P0kPamin-1,���Ա���𰸣�P0/30��


 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д� һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ֽ��ܵ��ȼҵ�¹��գ���������ȼ�ϵ������ϣ������������ͼ��ʾ(�缫δ���)������˵��������ǣ�
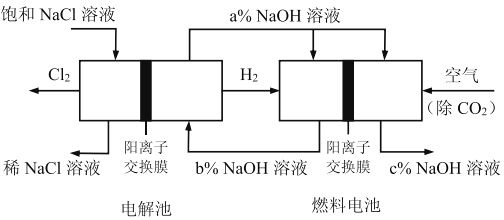
A. ���ص�������Ӧʽ2H2O+2e��=H2+2OH��
B. ��ͬ�����£�����������2LCl2��������ȼ�ϵ��Ӧ����1LO2
C. �������������ƶ�����������
D. ��Һa��b��c��pH��С˳��Ϊ��a>b>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ���Ͻ�(��������)����Ϊԭ�ϻ�������ͭ�Ĺ����������£�

����˵����ȷ����
A. ��ͭ���ڹ���ϡ���ᣬ���ˡ����¸���ô�ͭ
B. ���ʱ�ô�������������������ҺΪ�������Һ
C. ��ϡ���ᴦ������ʱ��Ҫ������������ԭ��Ӧ
D. ����ҺB�п�����ȡ�̷�(FeSO4��7H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Һ����������ˮ���ơ�T ��ʱ��NH3+NH3![]() NH4 ++NH2-��NH4+��ƽ��Ũ��Ϊ1��10-15 mol��L-1��������˵������ȷ����( )
NH4 ++NH2-��NH4+��ƽ��Ũ��Ϊ1��10-15 mol��L-1��������˵������ȷ����( )
A. �ڴ��¶���Һ�������ӻ�Ϊ1��10-14
B. ��Һ���з�������ƣ�������NaNH2
C. �����£���Һ���м���NH4Cl����ʹҺ�������ӻ���С
D. ���£���ʹҺ������ƽ�������ƶ�����c(NH4+)<c(NH2-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ�����о�NO2��NO��CO��NO2-��̼�⻯���������Ⱦ���ˮ��Ⱦ���ȴ����Խ��������й�������Ҫ���塣
��1����֪������β���е�CO��NOx��̼���������Ǵ�����Ⱦ�ʹ��ϡ���ȴ����ܽ�CO��NOת���������ʡ�
��֪:N2��g��+O2��g��=2NO��g�� ��H1=+180.5kJ/mol K1���÷�Ӧ��ƽ�ⳣ����
2C��s��+O2��g��=2CO��g�� ��H2=-221kJ/mol K2��ͬ�ϣ�
C��s��+O2��g��=CO2��g�� ��H3=-393.5kJ/mol K3��ͬ�ϣ�
д��NO��g����CO��g����ת����N2��g����CO2��g�����Ȼ�ѧ����ʽ________���Լ����Ȼ�ѧ����ʽ��ƽ�ⳣ��K=________����K1��K2��K3��ʾ��
��2����Ⱦ������NO2��CO��һ�������µķ�ӦΪ:2NO2+4CO![]() 4CO2+N2 ��H=-1200kJ/mol��
4CO2+N2 ��H=-1200kJ/mol��
��ij�¶��£���2L�ܱ������г���0.lmolNO2��0.2molCO����ʱ������ѹǿΪ1������ѹ��5��ʱ��Ӧ�ﵽƽ��ʱ��������ѹǿ��Ϊԭ����29/30����Ӧ��ʼ��ƽ��ʱNO2��ƽ����Ӧ����v��NO2=_____mol/��L��s����
����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ�����淴Ӧ�����ƶ�����_______��
A.��ʱ�����CO2
B.�ʵ������¶�
C.��С�������ʹ��ϵѹǿ����
D.ѡ���Ч����
��3���ڸ�Ч���������¿���NH3��ԭNO2������Ⱦ�ﴦ����
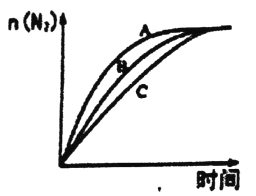
����ͬ�����£�ѡ��A��B��C���ִ������з�Ӧ�����ɵ��������ʵ�����ʱ��仯��ͼ�������С����________��
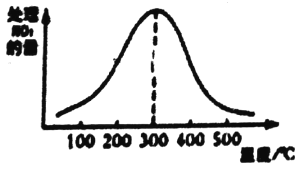
���ڴ���A�����²����ͬʱ�䴦��NO2�������¶ȹ�ϵ��ͼ����˵��ͼ��������������С��ԭ��___��������¶ȷ�Χ�ڴ����Ĵ�Ч����ͬ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������ϩ�����������ʵ�װ��ͼ����ش�

(1)д��Բ����ƿ�з�Ӧ�ķ���ʽ______________________________��
(2)��ƿ�л��Һ��ڣ�������ijЩ���������壬д��������������Ļ�ѧ����ʽ��____________________________________________��
(3)Ϊ�˼�����ϩ�����ɼ���ϩ�IJ������ԣ��Թ���Ӧʢ��_________������Ϊ___________��
(4)ϴƿ��ʢ�ŵ��Լ�Ϊ____________________������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ѧ������ʵ���е�Ӧ���������֪ʶ��ա�
(1)����6.02��1023����ԭ�ӵ�H2SO4�����ʵ�����_______.
(2)���״����VLCO2������ԭ����Ŀ��ͬ��ˮ��������_______g(�÷�ʽ��ʾ)
(3)��4gNaOH�ܽ���10mLˮ�У���ϡ�ͳ�1L������ȡ��10mL����10mL��Һ�����ʵ���Ũ��Ϊ________.
(4)��һ�����¶Ⱥ�ѹǿ��,1���X2(g)��3���Y2(g)��������2����������û�����Ļ�ѧʽ��________.
(5)��50mL0.1molL1NaCl��50mL0.5molL1CaCl2��Һ��Ϻ�,����Һ�����Ϊ�������֮��,������Һ��c(Cl)Ϊ_______.
(6)�������εĻ����Һ�к���0.2molNa+��0.25molMg2+��0.4molCl��SO42,��n(SO42)Ϊ_________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Һ����������ˮ���ơ�T ��ʱ��NH3+NH3![]() NH4 ++NH2-��NH4+��ƽ��Ũ��Ϊ1��10-15 mol��L-1��������˵������ȷ����( )
NH4 ++NH2-��NH4+��ƽ��Ũ��Ϊ1��10-15 mol��L-1��������˵������ȷ����( )
A. �ڴ��¶���Һ�������ӻ�Ϊ1��10-14
B. ��Һ���з�������ƣ�������NaNH2
C. �����£���Һ���м���NH4Cl����ʹҺ�������ӻ���С
D. ���£���ʹҺ������ƽ�������ƶ�����c(NH4+)<c(NH2-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��MgSO4��7H2O��ҽҩ�ϳ�����кҩ����ҵ�Ͽ����ȼҵ�е�һ������Ϊԭ��������֪һ�������к���þ���ơ����������̵Ĺ����κ�̼���εȳɷ�����Ҫ�������£�
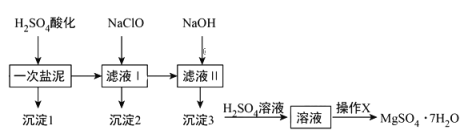
��ش��������⣺
��1��һ��������H2SO4��ַ�Ӧ�������1����ҺIʱ���õ��IJ��������в�������_____________��
��2��������X���ǽ���Һ___________��___________������ϴ�ӣ����õ�MgSO4��7H2O���壮
��3����NaClO��Һ��pH=5��6���������5-10���ӣ�����2����Ҫ����MnO2���������������������������Ļ�ѧʽ�ֱ�Ϊ___________��___________������NaClO��Һ��MnSO4ת��ΪMnO2�����ӷ���ʽΪ________��
��4�������Ƶõ���Ʒ5g����200mLˮ�ܽ⣬����2mol/L������5mL���ڲ��Ͻ����µμ�����2mol/LBaCl2��Һ����ַ�Ӧ�ó���4.66 g������Ʒ����Ϊ_______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com