
(16分)甲醇合成反应为:CO(g)+2H2(g)  CH3OH(g)。工业上用天然气为原料,分为两阶段:
CH3OH(g)。工业上用天然气为原料,分为两阶段:
Ⅰ、制备合成气:
用天然气和水制取原料气的方程式为: 。
原料气中常添加CO2以解决合成气中H2过量CO不足问题,请用方程式解释原因 。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为_________。
Ⅱ、合成甲醇:
(1)反应过程中物质能量变化如图所示。写出合成甲醇的热化学方程式____。

实验室在1L密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,分别恒温在3000C和5000C反应,每隔一定时间测得容器中甲醇的浓度如下:
10min | 20min | 30min | 40min | 50min | 60min | |
3000C | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
5000C | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
(2)在3000C反应开始10分钟内,H2的平均反应速率_____________。
(3)5000C平衡常数K=___________。
(4)在另一体积不变的容器中,充入1.2molCO和2.0molH2,一定条件下达到平衡,测得容器内压强为起始的一半。计算该条件下H2转化率为 。
Ⅰ、CH4+H2O(g)  CO+3H2,(2分) CO2+H2
CO+3H2,(2分) CO2+H2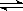 CO+H2O。(2分) 3:1 (2分)
CO+H2O。(2分) 3:1 (2分)
Ⅱ.(1)CO(g)+2H2(g) 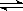 CH3OH(g) ΔH=(a-b)kJ/mol [ΔH=-(b-a)kJ/mol (3分)
CH3OH(g) ΔH=(a-b)kJ/mol [ΔH=-(b-a)kJ/mol (3分)
(2) 0.080mol/(L·min) (2分) (3) 25 (2分) (4) 80% (3分)
【解析】
试题分析:Ⅰ、制备合成气:
天然气的主要成分是甲烷,则用天然气和水制取原料气的方程式为CH4+H2O(g)  CO+3H2。由于在一定条件下CO2能与氢气反应生成CO和水,即CO2+H2
CO+3H2。由于在一定条件下CO2能与氢气反应生成CO和水,即CO2+H2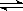 CO+H2O,所以原料气中常添加CO2以解决合成气中H2过量CO不足问题。CO和氢气按照1:2混合时恰好反应生成甲醇,为了使合成气配比最佳,可设甲烷的物质的量是x,CO2是y。甲烷产生的CO和氢气分别是x和3x,CO2消耗的氢气和产生的CO均是y,则有
CO+H2O,所以原料气中常添加CO2以解决合成气中H2过量CO不足问题。CO和氢气按照1:2混合时恰好反应生成甲醇,为了使合成气配比最佳,可设甲烷的物质的量是x,CO2是y。甲烷产生的CO和氢气分别是x和3x,CO2消耗的氢气和产生的CO均是y,则有 ,解得x:y=3:1。
,解得x:y=3:1。
Ⅱ、合成甲醇:
(1)反应过程中物质能量变化如图所示,根据图像可知反应放出的能量是bkJ—akJ,则合成甲醇的热化学方程式为CO(g)+2H2(g) 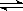 CH3OH(g) ΔH=—(b-a)kJ/mol。
CH3OH(g) ΔH=—(b-a)kJ/mol。
(2)在3000C反应开始10分钟内生成甲醇的物质的量浓度是0.4mol/L,则根据方程式CO(g)+2H2(g)  CH3OH(g)可知消耗氢气的浓度是0.8mol/L,所以H2的平均反应速率=0.8mol/L÷10min=0.080mol/(L·min)。
CH3OH(g)可知消耗氢气的浓度是0.8mol/L,所以H2的平均反应速率=0.8mol/L÷10min=0.080mol/(L·min)。
(3)5000C时反应进行到40min时达到平衡状态,产生甲醇是0.8mol/L,则消耗CO和氢气的浓度分别是0.8mol/L和1.6mo/L,则平衡时CO和氢气的浓度分别是0.2mol/L和0.4mol/L。根据化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值可知500℃时平衡常数K=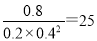 。
。
(4) CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
起始量(mol) 1.2 2 0
转化量(mol) x 2x x
平衡量(mol)1.2-x 2—2x x
所以根据平衡时容器内压强为起始的一半可知
解得x=0.8mol
因此氢气的转化率是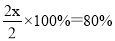
考点:考查可逆反应平衡状态的有关计算


科目:高中化学 来源:2014-2015福建省龙岩市一级达标校高一上学期期末化学试卷(解析版) 题型:选择题
下列各组离子,在强酸性溶液中可以大量共存的是
A.Mg2+、Fe3+、SCN-、Cl- B.Na+、K+、NO3- Ba2+
C.Na+、K+、HCO3-、Cl- D.Fe2+、I-、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省濉溪县高一上学期期末考试化学试卷(解析版) 题型:选择题
纯碱和小苏打都是白色晶体,在日常生活中都可以找到。若要在家中将它们区分开来,下面的方法中可行的是
A.分别放在炒锅中加热,观察是否有残留物
B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色
C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀
D.在水杯中各盛相同质量的样品,分别加入等体积的白醋,观察反应的剧烈程度
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省濉溪县高二上学期期末考试化学试卷(解析版) 题型:选择题
最新研究表明,咖啡中含有的咖啡酸是某种抗氧化剂的成分之一,对人体中的氧自由基有清除作用,使人的心脑血管更年轻。咖啡酸的球棍模型如图所示,下列有关咖啡酸的叙述中不正确的是

A.咖啡酸的分子式为C9H8O4
B.咖啡酸中的含氧官能团只有羧基、酚羟基两种
C.咖啡酸可以发生氧化反应、消去反应、酯化反应、加聚反应
D. 是咖啡酸的一种同分异构体,1mol该物质与NaOH溶液反应时最多消耗NaOH的物质的量为3 mol
是咖啡酸的一种同分异构体,1mol该物质与NaOH溶液反应时最多消耗NaOH的物质的量为3 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015安徽省濉溪县高二上学期期末考试化学试卷(解析版) 题型:选择题
进行一氯取代反应后,只能生成3种沸点不同的有机产物的烷烃是
A.(CH3)2CHCH2CH2CH3 B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2 D.(CH3)3CCH2CH3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三下学期一模考试化学试卷(解析版) 题型:选择题
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH— 2CO32— + 6H2O。则下列说法不正确的是
2CO32— + 6H2O。则下列说法不正确的是
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH3OH-6e—+8OH—=CO32— +6H2O
D.充电时每生成1 mol CH3OH转移6 mol电子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:实验题
(14分)海波(Na2S2O3·5H2O)常用手纺织和造纸工业,海波是无色透明的晶体,易溶于水,遇酸立即分【解析】
S2O32— + 2H+ =S↓+ SO2↑+ H2O。硫化碱法是工业上制备海波的方法之一,反应原理为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O,实验装置如下图所示:

(1)装置A中滴加浓硫酸的仪器名称是 ,发生反应的化学方程式是 ,实验室还可以用A装置制取的气体单质有 (填化学式)。
(2)装置C中连接多孔球泡可以提高SO2的吸收效率,其依据的原理是 。
(3)装置D的作用是检验装置C中SO2的吸收效率,D中的试剂可以是 。
a.品红溶液 b.氢氧化钠溶液
c.酚酞溶液 d.酸性高锰酸钾溶液
(4)装置E的作用是 。
(5)实验制得的Na2S2O3·5H2O产品中可能含有Na2SO3、Na2SO4等杂质。请设计实验,检测Na2S2O3·5H2O产品中是否存在Na2SO4杂质,简要说明实验操作、现象和结论: 。
(6)Na2S2O3溶液是定量实验中的常用试剂,为了测定某K2Cr2O7溶液的浓度,研究小组的同学准确量取10.00mL K2Cr2O7溶液于锥形瓶中,加入过量KI固体和适量的稀H2SO4,滴加指示剂,用0.1000 mol·L-1 Na2S2O3标准溶液滴定至终点,3次平行实验测得平均消耗Na2S2O3溶液的体积为30.00 mL,则c(K2Cr2O7) = mol·L-1。(已知:Cr2O72— +6I— +14H+=2Cr3+ +3I2 +7H2O,2S2O32— + I2=S4O62—+2 I—)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市高三3月质量检查化学试卷(解析版) 题型:选择题
化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是
A.稀的食盐水能杀死H7N9禽流感病毒
B.煤经过分馏和干馏两个物理变化,可变为清洁能源
C.电镀厂的废水直接用来灌溉农田,可提高水的利用率
D.用CO2合成聚碳酸酯可降解塑料,有利于减少白色污染
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省静宁县高一上学期期末考试化学试卷(解析版) 题型:选择题
下列各组离子在水溶液中能大量共存的是
A.Na+、Ba2+、Cl、SO42- B.Ca2+、HCO3、C1、K+
C.Mg2+、Ag+、NO3、Cl D.H+ 、Cl 、Na+ 、CO32
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com