
| A、钠是一种银白色金属 |
| B、熔点为97.81℃,密度为0.97 g?cm-3 |
| C、钠与H2O剧烈反应 |
| D、钠在室温下氧化和在空气中燃烧得到不同的产物 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| O2 |
| ① |
| O2 |
| ② |
| H2O |
| ③ |
| A、若X为N2或NH3,则A为硝酸 |
| B、若X为S或H2S,则A为硫酸 |
| C、若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y |
| D、反应①和一定为氧化还原反应,反应一定为非氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后HA溶液可能有剩余 |
| B、生成物NaA的水溶液的pH可能小于7 |
| C、HA溶液和NaOH溶液的体积可能不相等 |
| D、HA溶液的c(H+)和NaOH溶液的c(OH-) 可能不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热稳定性:Na2CO3>NaHCO3 |
| B、常温时在水中的溶解度:NaHCO3>Na2CO3 |
| C、与稀盐酸反应的剧烈程度:Na2CO3>NaHCO3 |
| D、等质量的固体与足量盐酸反应放出CO2的质量:Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
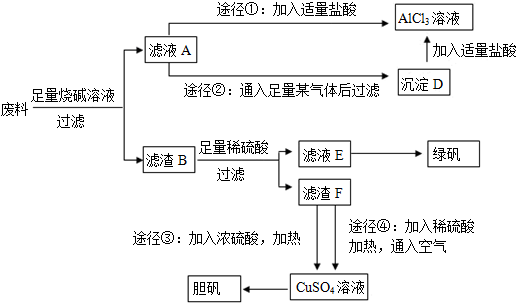
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
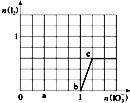 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示.则下列有关说法正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系曲线如图所示.则下列有关说法正确的是( )| A、b点时的还原产物可能是I2 |
| B、当n(KIO3)=1.1mol时,溶液中n(I-)=0.5mol |
| C、a点时剩余NaHSO3的物质的量为1.2mol |
| D、反应过程中的氧化反应所得产物均为SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com