
【题目】(7分)有以下物质:
①石墨;②铝;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;
⑦氢氧化钡溶液;⑧纯醋酸;⑨氧化钠固体;⑩氯化氢气体。
(1)其中能导电的是 ;属于非电解质的是 ;
属于强电解质的是 ;属于弱电解质的是 。
(2)写出物质⑥溶于水的电离方程式: 。
(3)写出物质⑥和⑧在水中反应的离子方程式: 。
(4)将物质⑥配制成溶液,逐滴加入⑦溶液中至沉淀量最大,写出离子方程式: 。
【答案】(7分)
(1)①②④⑦ ③⑤ ⑥⑨⑩ ⑧
(2)NaHCO3Na++HCO![]() (HCO
(HCO![]()
![]() H++CO
H++CO![]() )
)
(3)HCO![]() +CH3COOHCH3COO-+CO2↑+H2O
+CH3COOHCH3COO-+CO2↑+H2O
(4)Ba2++OH-+HCO![]() BaCO3↓+H2O
BaCO3↓+H2O
【解析】考查电解质概念及离子方程式的书写
(1)金属或有自由移动的离子才可导电,故①②④⑦可导电
强酸、强碱及大部分的盐为强电解质:⑥⑨⑩
弱酸、弱碱及水为弱电解质:⑧
而非电解质包括:③⑤
(2)碳酸氢钠为强电解质,全部电离:NaHCO3Na++HCO![]()
(3)醋酸为弱酸,不能拆为离子:HCO![]() +CH3COOHCH3COO-+CO2↑+H2O
+CH3COOHCH3COO-+CO2↑+H2O
(4)设NaHCO3的物质的量为1mol,则需要消耗1mol 的OH—:HCO![]() +OH—=CO
+OH—=CO![]() +H2O,生成的CO
+H2O,生成的CO![]() 又需要消耗1molBa2+生成沉淀:Ba2++OH-+HCO
又需要消耗1molBa2+生成沉淀:Ba2++OH-+HCO![]() BaCO3↓+H2O
BaCO3↓+H2O


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】请用序号填空:
①13C与14C ②正丁烷与异丁烷
③CH3CH3与CH3CH2CH3 ④
(1)属于同位素的是______;
(2)属于同系物的是______;
(3)属于同分异构体的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向IL0.1mol/LNH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如右图所示(不考虑体积变化和氨的挥发),下列说法不正确的是

A.M点溶液中水的电离程度比原溶液小
B.在M点时,n(OH-)-n(H+)=(a-0.05)mol
C.随者NaOH的加入,c(H+)/c(NH4+)不断增大
D.当n(NaOH)=0.1mol时,c(OH-)>c(Cl-)-c(NH3·H20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校探究性学习小组用已部分生锈的废铁屑制作印刷电路板的腐蚀剂,并回收铜。探究过程如下:
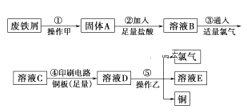
请回答下列问题:
(1)步骤①中先加入热的Na2CO3溶液除油污,操作甲的名称是_____。
(2)步骤②中,除发生反应Fe+2HCl=FeCl2+H2↑外,其他可能反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O和____。
(3)溶液C的颜色是____,溶液D中可能含有的金属阳离子有___。
(4)可以验证溶液B中是否含有Fe2+的一种试剂是____(填选项序号)。
a.稀硫酸 b.铁 c.硫氰化钾 d.酸性高锰酸钾溶液
(5)操作乙的名称是___,步骤⑤产生金属铜的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为HOOC![]() CH2—COOH,下列说法正确的是
CH2—COOH,下列说法正确的是
A. 苹果酸中能发生酯化反应的官能团有2种
B. 1mol苹果酸可与3mol NaOH发生中和反应
C. 1mol苹果酸与足量金属Na反应生成生成1mol H2
D. HOOC—CH2—CH(OH)—COOH与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有化合物:
甲: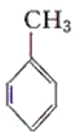 乙:
乙: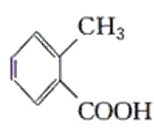 丙:
丙: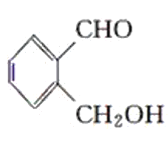
(1)请判别上述哪些化合物互为同分异构体(填序号):____________。
(2)请用一种试剂鉴别甲、乙、丙化合物。在下表中填入所选试剂及主要现象即可。________
试剂 | 现象 | |
甲 | ||
乙 | ||
丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含镍![]() 废料中有FeO、
废料中有FeO、![]() 、MgO、
、MgO、![]() 等杂质,用此废料提取
等杂质,用此废料提取![]() 的工艺流程如图1:
的工艺流程如图1:
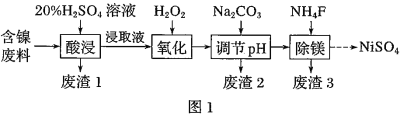
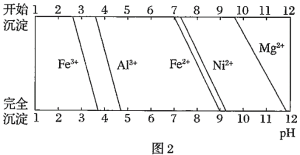
已知:①有关金属离子生成氢氧化物沉淀所需的pH如图.
②![]() 时,
时,![]() 的电离常数
的电离常数![]() 的电离常数
的电离常数![]() ,
,![]()
![]() .
.
(1)加![]() 调节溶液的pH至5,得到废渣2的主要成分是______
调节溶液的pH至5,得到废渣2的主要成分是______![]() 填化学式
填化学式![]() .
.
(2)![]() 能与饱和
能与饱和![]() 溶液反应产生
溶液反应产生![]() ,请用化学平衡移动原理解释
,请用化学平衡移动原理解释![]() 用必要的文字和离子方程式回答
用必要的文字和离子方程式回答![]() ______.
______.
(3)![]() 时,
时,![]() 的NaF溶液中
的NaF溶液中![]() ______
______![]() 列出计算式即可
列出计算式即可![]() 溶液呈______
溶液呈______![]() 填“酸性”、“碱性”或“中性”
填“酸性”、“碱性”或“中性”![]() .
.
(4)已知沉淀前溶液中![]() ,当除镁率达到
,当除镁率达到![]() 时,溶液中
时,溶液中![]() ______
______![]() .
.
(5)在NaOH溶液中用NaClO与![]() 反应可得
反应可得![]() ,化学方程式为____________;
,化学方程式为____________;![]() 与贮氢的镧镍合金可组成镍氢碱性电池
与贮氢的镧镍合金可组成镍氢碱性电池![]() 溶液
溶液![]() ,工作原理为:
,工作原理为:![]() ,负极的电极反应式:______.
,负极的电极反应式:______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:
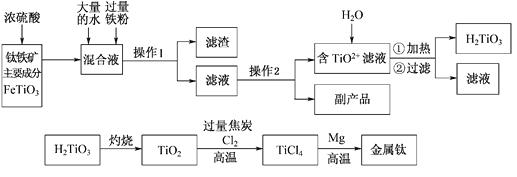
已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有________________________;
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理_____________________。
(3)已知钛的还原性介于铝与锌之间。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是___________________________________。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是_____________________________________。
(5)为测定溶液中TiOSO4的含量,先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取无色滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用______________________(填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。滴定终点时的现象是________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的综合利用对促进“低碳经济”的发展有重要意义。
(1)工业上以CO2、NH3为原料生产尿素[CO(NH2)2],反应实际为两步进行:
I:2NH3(g)+CO2(g)![]() H2NCOONH4(s) △H1=-272kJ·mol-1
H2NCOONH4(s) △H1=-272kJ·mol-1
II:H2NCOONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+138kJ·mol-1
已知:H2O(l)==H2O(g) △H3=+44kJ·mol-1
①请写出以NH3、CO2为原料,合成尿素和液态水的热化学方程式______________。
②T1℃时,在1L的密闭容器中充入CO2和NH3模拟工业生产,n(NH3)/n(CO2)=x,如图是CO2平衡转化率(![]() )与x的关系。求图中A点NH3的平衡转化率
)与x的关系。求图中A点NH3的平衡转化率![]() =________%。
=________%。
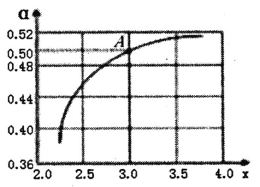
③当x=1.0时,若起始的压强为p0kPa,水为液态,平衡时压强变为起始的1/2。则该反应的平衡常数Kp=_______(kPa)-3(KP为以分压表示的平衡常数)。
(2)用CO2和H2合成甲醇:3H2(g)+CO2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。在T℃时,甲、乙、丙三个2L的恒容密闭容器中,按不同方式投入反应物,测得平衡时有关数据如下:
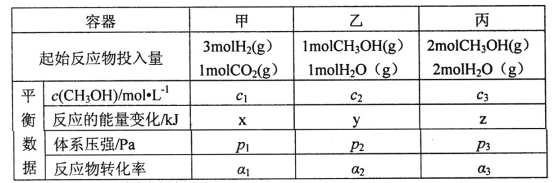
①甲容器10s达到平衡时测得x=39.2,则甲中CO2的平均反应速率____________。
②下列说法正确的是________(填字母编号)。
A.2c1<c3 B.z<2y C.p3>2p2 D.α1+α3>1
(3)用NaOH溶液做碳捕捉剂可获得化工产品Na2CO3。常温下若某次捕捉后得到pH=10的溶液,则溶液中c(CO32-):c(HCO3-)=_____[K1(H2CO3)=4.4×10-7、K2(H2CO3)=5×10-11],溶液中c(Na+)_____c(HCO3-)+2c(CO32-)(填“>”“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com