
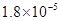 ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=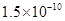
 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

 mol·L-1HF溶液与
mol·L-1HF溶液与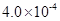 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), (填“有”或“无”)沉淀产生。| A.NH4Cl | B.NH4SCN? | C.CH3COONH4 | D.NH4HCO3 |


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)达平衡,设初始A、B的物质的量分别为Xmol、Ymol,若要使平衡时反应物总物质的量与生成物总物质的量相等,则X/Y应满足的是
2C(g)达平衡,设初始A、B的物质的量分别为Xmol、Ymol,若要使平衡时反应物总物质的量与生成物总物质的量相等,则X/Y应满足的是 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z(g)达到限度的标志是
2Z(g)达到限度的标志是 | A.单位时间内生成3n mol X,同时消耗nmol Y |
| B.X的生成速率与Z的生成速率相等 |
| C.X、Y、Z的浓度相等 |
| D.X、Y、Z的分子个数比为3:1:2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 3C(g)。
3C(g)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 = mol/(L·min)
= mol/(L·min)| A.升高温度 | B.恒容时充入氮气 |
| C.将水蒸气从体系中分离 | D.用更有效的催化剂 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.对2HI(g) H2(g)+I2(g),平衡体系增大压强可使颜色变深 H2(g)+I2(g),平衡体系增大压强可使颜色变深 |
B.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 |
C.CO+NO2 CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 CO2+NO(正反应为放热反应),升高温度可使平衡向逆反应方向移动 |
| D.往H2S水溶液中加碱有利于S2-的增加 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g)已达到平衡状态的现象是
C(g)+D(g)已达到平衡状态的现象是 | A.混合气体的压强 | B.混合气体的密度 |
| C.气体的总物质的量 | D.单位时间内生成n mol C的同时消耗2n molB |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如右图所示。则下列说法正确的是( )
U (l) 。取等量的E,分别在20℃、50℃测得E的转化率随时间变化的关系曲线(Y-t)如右图所示。则下列说法正确的是( )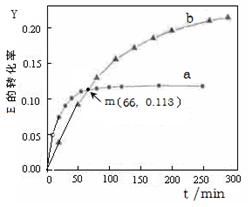
| A.该反应的?H > 0 |
| B.b代表50℃下E的Y-t曲线 |
| C.m点(66,0.113)时有: ?n (E, 20℃) = ?n (E,50℃) |
| D.升高温度可以缩短达到平衡的时间,提高E的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com