
| A、石墨 |
| B、NaOH溶液 |
| C、乙醇 |
| D、Na2CO3 |


科目:高中化学 来源: 题型:
| A、H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 |
| B、在H2O2分解过程中,溶液的H+浓度逐渐下降 |
| C、在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 |
| D、H2O2生产过程中往往需要加入少量Fe2+以提高产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | MgSO4、NaNO3、KNO3、 |
| 第二次 | Mg (NO3)2、KNO3、Na2SO4 |
| 第三次 | Mg (NO3)2、Ba(NO3)2、Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

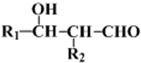
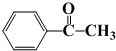 )的合成路线(不超过四步)(合成路线常用的表示方式为:A
)的合成路线(不超过四步)(合成路线常用的表示方式为:A| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol?L-1 H2SO4/mL | 30 | V1 | V2 | V3 | 30 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中加AgNO3溶液产生白色沉淀,证明有Cl- |
| B、向某溶液中加稀 HCl,无明显现象,再加入BaCl2 溶液产生白色沉淀,证明有SO42- |
| C、向某溶液中加入稀 HCl,放出能使澄清的石灰水变浑浊的气体,证明有CO32- |
| D、加浓氢氧化钠溶液后加热,产生使湿润蓝色石蕊试纸变红的气体,证明含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(HCOO-)>c(Na+) |
| B、c(HCOO-)<c(Na+) |
| C、c(HCOO-)=c(Na+) |
| D、无法确定c(HCOO-)与c(Na+)的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
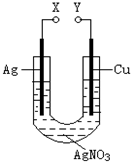
| A、X和Y不连接时,铜棒上会有金属银析出 |
| B、X和Y用导线连接时,银棒是正极,发生氧化反应 |
| C、若X接直流电源的正极,Y接负极,Ag+向铜电极移动 |
| D、无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com