
【题目】为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是
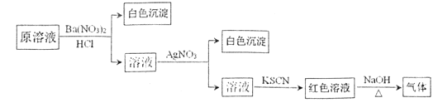
A.原溶液中一定含有![]() 离子B.原溶液中一定含有
离子B.原溶液中一定含有![]()
C.原溶液中一定含有Cl-离子D.原溶液中一定含有Fe3+离子
【答案】B
【解析】
由题干可知检验过程中产生的气体能使湿润的红色石蕊试纸变蓝,那么该气体为NH3,红色溶液中含有![]() ;加入了KSCN的溶液显红色,说明更溶液中含有Fe3+;加入盐酸酸化的硝酸钡溶液产生白色沉淀,原溶液中可能含有硫酸根或者亚硫酸根,据此判断。
;加入了KSCN的溶液显红色,说明更溶液中含有Fe3+;加入盐酸酸化的硝酸钡溶液产生白色沉淀,原溶液中可能含有硫酸根或者亚硫酸根,据此判断。
A.加入盐酸酸化的硝酸钡溶液产生白色沉淀,原溶液中可能含有硫酸根或者亚硫酸根,A项错误;
B.由题干可知检验过程中产生的气体能使湿润的红色石蕊试纸变蓝,那么该气体为NH3,红色溶液中含有![]() ,B项正确;
,B项正确;
C.由于原溶液中加入了盐酸酸化的硝酸钡溶液,虽然加入硝酸银溶液产生了白色沉淀,但不能确定原溶液中有无Cl-,可能是盐酸引入的Cl-形成的白色沉淀,C项错误;
D.盐酸酸化的硝酸钡溶液可将溶液中的Fe2+氧化为Fe3+,因而不能确定溶液中一定含有Fe3+,D项错误;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )。
A.1mol Na被完全氧化生成Na2O2,失去个NA电子
B.标准状况下,22.4L盐酸含有NA个HCl分子
C.标准状况下,5.6L CO2与足量Na2O2反应转移的电子数为0.5NA
D.50mL 12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是合成抗心律失常药物泰达隆的一种中间体,可通过以下方法合成:

(1)D中的含氧官能团名称为________________(写两种)。
(2)F→G的反应类型为________________。
(3)写出同时满足下列条件的C的一种同分异构体的结构简式________________。
①能发生银镜反应;
②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应;
③分子中只有4种不同化学环境的氢。
(4)E经还原得到F,E的分子是为C14H17O3N,写出E的结构简式____________。
(5)已知:①苯胺(![]() )易被氧化
)易被氧化

请以甲苯和(CH3CO)2O为原料制备 ,写出制备的合成路线流程图________。(无机试剂任用,合成路线流程图示例见本题题干)
,写出制备的合成路线流程图________。(无机试剂任用,合成路线流程图示例见本题题干)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不用任何试剂,只用试管和胶头滴管就可以鉴别开来的一组是:( )
(1)![]() 溶液和
溶液和![]() 溶液 (2)NaOH溶液和
溶液 (2)NaOH溶液和![]() 溶液
溶液
(3)HCl溶液和![]() 溶液 (4)AlCl3溶液和氨水溶液
溶液 (4)AlCl3溶液和氨水溶液
A.(1)(2)(3)B.(2)(3)(4)C.(1)(2)D.(2)(3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某地粉煤灰中镓含量丰富,其主要成分以Ga2O3的形式存在,除此之外还含有A12O3、Fe3O4、SiO2等杂质。已知从粉煤灰中回收镓的艺流程如图甲所示。
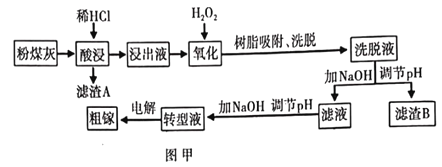
信息:(i)转型液中镓以GaO2-的形式存在;
(ii)Ksp[Ga(OH3)]=1.4×10-34,Ksp[Fe(OH)3]=2.7×10-39,Ksp[Fe(OH)2]=4.87×10-17。
回答下列问题:
(1)滤渣A中一定含有的成分是___________。
(2)“氧化”过程中加入H2O2的目的是___________,该过程中发生反应的离子方程式为___________。
(3)洗脱液中还有少量的Fe3+、Ga3+,其中Ga3+浓度为1.4×10-4mol/L,列式计算当Fe3+恰好沉淀完全时[c(Fe3+)≤1.0×10-5mol/L],G a3+是否开始沉淀___________。
(4)流程图中两次调节pH的目的分别是___________。
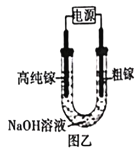
(5)电解法可以提纯粗镓,具体原理如图乙所示①粗镓与电源___________极相连(填“正”或“负”)。②镓在阳极溶解生成的Ga3+与NaOH溶液反应生成GaO2-,GaO2-在阴极放电的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D之间的转化关系如图所示。下列说法正确的是( )

A.若A为Fe,C为氢气,则B一定是酸
B.若A为H2O,B、D为化合物,则C一定是气体单质
C.若C为单质,D为化合物,则A、B中一定有一种物质是单质
D.若D为单质,A、B为化合物,该反应一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如下图所示,下列有关说法错误的是
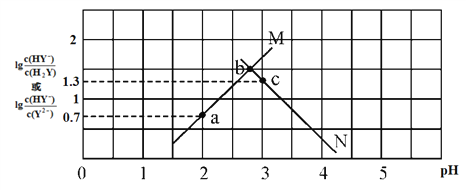
A. 曲线 M 表示 pH与 lg![]() 的变化关系
的变化关系
B. a点溶液中:c(H+) ― c(OH-)=2c(Y2-)+c(HY-) ― c(K+)
C. H2Y 的第二级电离常数Ka2(H2Y)=10-4.3
D. 交点b的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。常用的自来水消毒剂有二氧化氯(ClO2)和高铁酸钾(K2FeO4)等。
(1)某研究小组用下图装置制备少量ClO2(夹持装置已略去)。
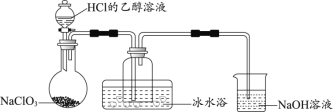
资料:ClO2常温下为易溶于水而不与水反应的气体,水溶液呈深黄绿色,11℃时液化成红棕色液体。以NaClO3和HCl的乙醇溶液为原料制备ClO2的反应为2NaClO3 + 4HCl= 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O。
①冰水浴的作用是____________。
② NaOH溶液中发生的主要反应的离子方程式为________________。
(2)将ClO2水溶液滴加到KI溶液中,溶液变棕黄;再向其中加入适量CCl4,振荡、静置,观察到____,证明ClO2具有氧化性。
(3)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO2-),需将其转化为Cl-除去。下列试剂中,可将ClO2-转化为Cl-的是_____________________(填字母序号)。
a. FeSO4 b. O3 c. KMnO4 d. SO2
(4)K2FeO4是一种新型、绿色的多功能净水剂,集氧化、吸附、絮凝、沉淀、灭菌、消毒、脱色、除臭等性能为一体。实验室制备K2FeO4的方法如下:在冰水浴中,向KClO和KOH的混合溶液中少量多次加入硝酸铁,并不断搅拌。
①上述制备K2FeO4反应的离子方程式为______________________。
②净水过程中,K2FeO4起到吸附、絮凝作用的原理是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
(1)A的结构简式为_______。
(2)A中的碳原子是否都处于同一平面?________(填“是”或“不是”)。
(3)在下图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
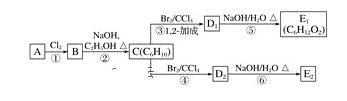
C的化学名称是_____;反应⑤的化学方程式为_________________;E2的结构简式是_____;④的反应类型是______,⑥的反应类型是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com