

分析 A是一个国家的有机化工发展的水平的标志,则A为C2H4,由转化关系可知,B、C、D、E是A的衍生物,C是生活中常见有机物,A与水发生加成反应得C为C2H5OH,A与氯化氢加成得B为CH3CH2Cl,B碱性水解得C,C氧化得D为CH3CHO,D氧化得E为CH3COOH,E与C发生酯化反应得F为CH3COOC2H,符合各物质的转化关系,据此解答.
解答 解:A是一个国家的有机化工发展的水平的标志,则A为C2H4,由转化关系可知,B、C、D、E是A的衍生物,C是生活中常见有机物,A与水发生加成反应得C为C2H5OH,A与氯化氢加成得B为CH3CH2Cl,B碱性水解得C,C氧化得D为CH3CHO,D氧化得E为CH3COOH,E与C发生酯化反应得F为CH3COOC2H,
(1)根据上面的分析可知,B为CH3CH2Cl,D为CH3CHO,故答案为:CH3CH2Cl;CH3CHO;
(2)B→C的化学方程式为:CH3CH2Cl+NaOH $→_{△}^{醇}$CH2CH2+NaCl+H2O; C→D的化学方程式为:CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,D与新制的氢氧化铜共热的化学方程式为CH3CHO+2Cu(OH)2 $\stackrel{△}{→}$ CH3COOH+Cu2O+2H2O,
故答案为:CH3CH2Cl+NaOH $→_{△}^{醇}$CH2CH2+NaCl+H2O;CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;CH3CHO+2Cu(OH)2 $\stackrel{△}{→}$ CH3COOH+Cu2O+2H2O;
(3)E为CH3COOH,E的一种用途是调味剂(或除锅垢或软化鱼刺等),故答案为:调味剂(或除锅垢或软化鱼刺等).
点评 本题考查有机物的推断,涉及烯、醇、醛、羧酸等的性质与转化等,根据A的性质利用顺推法进行推断,难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时应使温度计水银球与蒸馏烧瓶支管口平齐 | |
| C. | 蒸发时,待蒸发皿中没有水了再停止加热 | |
| D. | 称量氢氧化钠时,应先将小烧杯放在左盘称量,再将药品加入到小烧杯中称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验用品 | 溶液温度 | 中和热 | ||
| t1 | t2 | △H | ||
| ① | 50 mL0.55 mol•L-1NaOH溶液 | 20℃ | 23.3℃ | |
| 50 mL0.5 mol•L-1HCl溶液 | ||||
| ② | 50 mL0.55 mol•L-1NaOH溶液 | 20℃ | 23.5℃ | |
| 50 mL0.5 mol•L-1HCl溶液 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、醛基-CHO、羧基-COOH、-COOR酯基.
、醛基-CHO、羧基-COOH、-COOR酯基.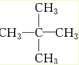 ,名称为2,2-二甲基丙烷.
,名称为2,2-二甲基丙烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发法进行海水淡化 | |
| B. | 用酒精萃取碘水中的碘 | |
| C. | 用渗析的方法除去淀粉溶液中含有的少量NaCl | |
| D. | 用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com