
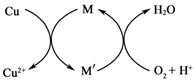
分析 (1)①45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2•3H2O,反应物为CuCl、氧气、水;
②Fe3+对该反应有催化作用,结合图可知,Cu元素的化合价升高,则M中Fe元素的化合价降低;
(2)由②可知n(Cl-)=n(AgCl)×$\frac{100.00mL}{25.00mL}$=$\frac{0.1722g}{143.5g/mol}×\frac{100.00mL}{25.00mL}$=4.800×10-3mol,由③可知n(Cu2+)=n(EDTA)×$\frac{100.00mL}{25.00mL}$=0.08000 mol•L-1×30.00 mL×10-3 L•mL-1×$\frac{100.00mL}{25.00mL}$=9.600×10-3 mol,结合化合物中正负化合价的代数和为0及物质定组成来计算.
解答 解:(1)①45~50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2•3H2O,反应物为CuCl、氧气、水,Cu元素的化合价升高,O元素的化合价降低,由原子、电子守恒可知反应为4CuCl+O2+8H2O$\frac{\underline{\;45-50℃\;}}{\;}$2Cu2(OH)2Cl2•3H2O,
故答案为:4CuCl+O2+8H2O$\frac{\underline{\;45-50℃\;}}{\;}$2Cu2(OH)2Cl2•3H2O;
②Fe3+对该反应有催化作用,结合图可知,Cu元素的化合价升高,则M中Fe元素的化合价降低,可知M′的化学式为Fe2+,
故答案为:Fe2+;
(2)n(Cl-)=n(AgCl)×$\frac{100.00mL}{25.00mL}$=$\frac{0.1722g}{143.5g/mol}×\frac{100.00mL}{25.00mL}$=4.800×10-3mol,
n(Cu2+)=n(EDTA)×$\frac{100.00mL}{25.00mL}$=0.08000 mol•L-1×30.00 mL×10-3 L•mL-1×$\frac{100.00mL}{25.00mL}$=9.600×10-3 mol,
n(OH-)=2n(Cu2+)-n(Cl-)=2×9.600×10-3 mol-4.800×10-3 mol=1.440×10-2 mol,
m(Cl-)=4.800×10-3 mol×35.5 g•mol-1=0.1704 g,
m(Cu2+)=9.600×10-3 mol×64 g•mol-1=0.6144 g,
m(OH-)=1.440×10-2 mol×17 g•mol-1=0.2448 g,
n(H2O)=$\frac{1.1160g-0.1704g-0.6144g-0.2448g}{18g/mol}$=4.800×10-3 mol,
则a:b:c:x=n(Cu2+):n(OH-):n(Cl-):n(H2O)=2:3:1:1,
即化学式为Cu2 (OH)3Cl•H2O,
答:该样品的化学式为Cu2 (OH)3Cl•H2O.
点评 本题考查物质的制备及物质组成的测定实验,为高频考点,把握发生的反应、物质的量的计算为解答的关键,侧重分析能力和实验能力的考查,注意氧化还原反应及定组成的应用,题目难度中等.


 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol葡萄糖能水解生成2molCH3CH2OH和2molCO2 | |
| B. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| C. | 油脂不是高分子化合物,1mol油脂完全水解生成1mol甘油和3 mol高级脂肪酸(盐) | |
| D. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象及结论 |
| A | 将AlC13溶液加热蒸干 | 得到白色固体,成分为纯净的AlC13 |
| B | 将少量Na2SO3样品溶于水,滴加足量盐酸酸化的Ba(NO3)2溶液 | 有白色沉淀产生,则Na2SO3己变质 |
| C | 用量筒量取一定体积的浓硫酸时,仰视读数 | 所量取的浓硫酸体积偏大 |
| D | 向FeI2溶液中通入少量C12 | 溶液变黄,则C12的氧化性强于Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a和b都属于芳香族化合物 | |
| B. | a和c分子中所有碳原子均处于同一平面上 | |
| C. | a、b和c均能使酸性KMnO4溶液褪色 | |
| D. | b和c均能与新制的Cu(OH)2反应生成红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
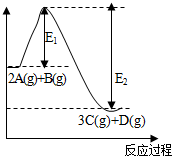 反应2A(g)+B(g)?3C(g)+D(g),△H=akJ/mol.反应过程中的能量变化如图所示.回答下列问题:
反应2A(g)+B(g)?3C(g)+D(g),△H=akJ/mol.反应过程中的能量变化如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该有机物中含有2个碳原子和6个氢原子 | |
| B. | 该有机物中碳和氢的原子个数比为3:1 | |
| C. | 该有机物中含有2个CO2和3个H2O | |
| D. | 该有机物的1个分子里含2个碳原子和6个氢原子,还可能含有氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧酸的酸性由强到弱的顺序:E、D、A | |
| B. | 简单气态氢化物的稳定性由强到弱的顺序:B、D、E | |
| C. | B、C、E形成的共价化合物CEB可以用来杀菌消毒 | |
| D. | 简单离子半径由大到小的顺序:D、E、B、C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>W>X | B. | 简单气态氢化物的热稳定性:X>Z | ||
| C. | 野外钢轨焊接中常用到Y的单质 | D. | 加热条件下Q可氧化X、Y、Z的单质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com