
 实验室制备乙酸乙酯,回答有关问题:
实验室制备乙酸乙酯,回答有关问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.分析 (1)酯化反应的本质为酸脱羟基,醇脱氢,在A中反应生成乙酸乙酯和水,且为可逆反应;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层;
(3)乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
(4)分离互不相溶的液体通常用分液的方法.
解答 解:(1)酯化反应的本质为酸脱羟基,醇脱氢,在A中乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(2)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层,所以b中盛放的液体为饱和碳酸钠溶液,
故答案为:饱和碳酸钠溶液;
(3)乙酸与乙醇发生酯化反应,该反应为可逆反应,需浓硫酸作催化剂,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,故浓硫酸的作用为催化剂、吸水剂,
故答案为:催化作用、吸水作用;
(4)因B中的液体混合物分层不互溶,乙酸乙酯在上层,可用分液方法分离,
故答案为:分液.
点评 本题考查乙酸乙酯的制备,题目难度不大,注意理解饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
| 实验编号 | 盐酸浓度 | 反应温度/℃ | 收集100mL氢气所需时间/s |
| ① | 1mol/L | 15 | 200 |
| ② | 1mol/L | 25 | 90 |
| ③ | 2mol/L | 25 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成n mol O2的同时生成n mol NO2 | |
| B. | 混合气体的颜色不再改变的状态 | |
| C. | ν(NO2):ν(NO):ν(O2)=2:2:1的状态 | |
| D. | 混合气体的密度不再改变的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、SO42-、Cl- | B. | Na+、AlO2- K+、SO42- | ||
| C. | MnO${\;}_{4}^{-}$、K+、SO42-、Na+ | D. | NH4+、NO3-、Fe2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HOCH2CH2OH | B. | HOCH2CH(OH)CH3 | C. | CH3CH2CH2OH | D. | CH3CH(OH)CH(OH)CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
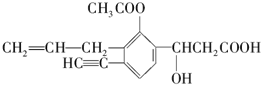 某有机化合物结构如下,分析其结构并完成下列问题:
某有机化合物结构如下,分析其结构并完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
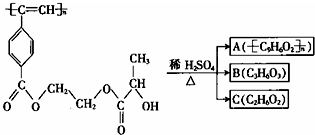
| A. | M和A均能使酸性KMnO4溶液和溴水褪色 | |
| B. | B(C3H6O3)能发生消去反应和酯化反应 | |
| C. | 1mol M与足量热的烧碱溶液反应,最多可消耗2n mol NaOH | |
| D. | A、B、C各1mol分别与足量金属钠反应,放出气体的物质的量之比为1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油常压分馏可得直馏汽油,石油汽可用作石油裂化的原料 | |
| B. | 石油裂解的目的是为了得到乙烯、丙烯和甲烷等化工原料 | |
| C. | 煤的干馏发生了物理变化,石油的减压分馏是化学变化 | |
| D. | 煤中含有苯和甲苯,可以通过先干馏后分馏的方法得到苯和甲苯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com