
分析 (1)根据m=nM进行计算,1mol H2SO4中含有2mol氢原子;
(2)根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$计算;
(3)根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$计算,结合分子结构分析;
(4)结合c=$\frac{n}{V}$、n=$\frac{V}{{V}_{m}}$计算;
(5)由化学式可知2n(MCl2)=n(Cl-),据此计算n(MCl2),再根据M=$\frac{m}{n}$计算MCl2的摩尔质量,进而计算M的相对原子质量.
解答 解:(1)0.2mol H2SO4的质量为0.2×98=19.6g,其中含有 0.2×2=0.4mol 的氢原子,含有氧的质量为:0.2×4×16=12.8g,故答案为:19.6g;0.4;12.8g;
(2)n(N2)=$\frac{5.6g}{28g/mol}$=0.2mol,V(N2)=0.2mol×22.4L/mol=4.48L,N(N2)0.2mol×6.02×1023/mol=1.204×1023,
故答案为:4.48L;1.204×1023;
(3)则9.03×1023个氨(NH3)分子含氨分子的物质的量为$\frac{9.03×1{0}^{23}}{6.02×1{0}^{23}}$=1.5mol;1个氨分子中含有3个氢原子,则9.03×1023个氨(NH3)分子含1.5mol×3=4.5mol氢原子;1个氢原子中含有1个质子,1个电子,1个氮原子中含有7个质子,7个电子,则1个氨分子中含有10个质子、8个电子,则9.03×1023个氨(NH3)分子含1.5mol×10=15mol质子,所以所含质子数为:15NA或9.03×1024,故答案为:1.5; 15NA或9.03×1024;
(4)标准状况下448mL的HCl溶于水配成100mL的溶液,所得溶液的物质的量浓度为$\frac{\frac{0.448L}{22.4L/mol}}{0.1L}$=0.2mol/L,
故答案为:0.2mol/L;
(5)金属氯化物MCl2 19g,含有Cl- 0.4mol,则n(MCl2)=$\frac{0.4mol}{2}$=0.2mol,MCl2的摩尔质量=$\frac{19g}{0.2mol}$=95 g•mol-1,故M的相对原子质量=95-35.5×2=24,
故答案为:95 g•mol-1; 24.
点评 本题考查有关物质的量的计算,比较基础,侧重对基础知识的巩固,注意理解摩尔质量与质量、物质的量的关系,掌握相对分子质量的计算常用方法.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:解答题
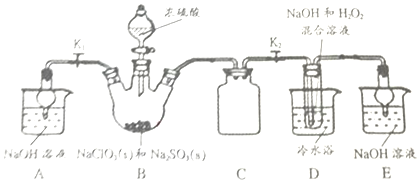
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
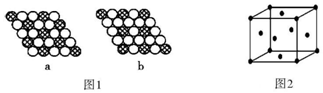 第四周期中的 18 种元素具有重要的用途.
第四周期中的 18 种元素具有重要的用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3$→_{△}^{NaOH(aq)}$NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| B. | Fe2O3$\stackrel{盐酸}{→}$FeCl2$\stackrel{Cu}{→}$Fe | |
| C. | FeS2$\stackrel{O_{2}/高温}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| D. | NH3$→_{催化剂}^{O_{2},△}$NO$\stackrel{H_{2}O}{→}$HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将AgNO3溶液滴入集气瓶中,观察是否生成白色沉淀 | |
| B. | 用手将湿润的淀粉碘化钾试纸放在集气瓶上方,观察试纸是否变蓝 | |
| C. | 将湿润的淀粉碘化钾试纸粘在玻棒一端,伸到集气瓶口,观察试纸是否变蓝 | |
| D. | 将紫色石蕊试液滴入集气瓶中,观察试液是否先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M形成+2价阳离子 | B. | Y形成+2价阳离子 | C. | Z可表示为MY2 | D. | Z的熔点较高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑥ | B. | ①②③⑤ | C. | ②④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只产生BaSO4沉淀 | B. | 只产生BaSO3沉淀 | ||
| C. | 一定有BaSO4和BaSO3沉淀 | D. | 一定有SO2、SO3气体逸出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com