
P4(s)+5O2(g)![]() P4O10(s) ��H=-3 903.2 kJ��mol-1 ��
P4O10(s) ��H=-3 903.2 kJ��mol-1 ��
4P(s)+5O2(g) ![]() P4O10(s) ��H=-2 954.0 kJ��mol-1 ��
P4O10(s) ��H=-2 954.0 kJ��mol-1 ��
�ɴ��ж�����˵����ȷ����
A.�ɺ���ת��Ϊ���������ȷ�Ӧ��������ʱ���������Ȱ���
B.�ɺ���ת��Ϊ�����Ƿ��ȷ�Ӧ��������ʱ���������Ȱ���
C.�ɺ���ת��Ϊ�����Ƿ��ȷ�Ӧ��������ʱ���������Ȱ���
D.�ɺ���ת��Ϊ���������ȷ�Ӧ��������ʱ���������Ȱ���

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
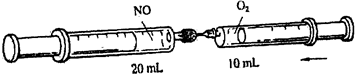
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
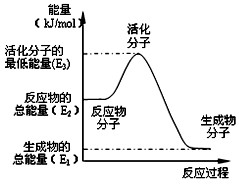 �״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ���ǣ�
�״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧԭ���ǣ�| 1 |
| 2 |
| A����Ӧ���е������仯��ͼ��ʾ�����H2=E1-E3 |
| B��CH3OH��ȼ���ȡ�H=-192.9 kJ?mol -1 |
| C��H2ȼ���ܷų��������ȣ���CH3OHת���H2�Ĺ��̱����������� |
| D�����ݢ���֪����25�棬101 kPaʱ��1mol CH3OH��g��ȼ������CO2��H2O��l���ų�������Ӧ����192.9 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������������������۷ֱ���ȫȼ�գ�ǰ�߷ų������� | B���ɡ�C��ʯī��=C�����ʯ������H=+l.9 kJ?mol-1����֪���ʯ��ʯī�ȶ� | C��ϡ��ǿ���ϡ��ǿ����Һ��Ӧ���Ȼ�ѧ����ʽ��Ϊ��H++OH-=H2O��l������H=-57.3 kJ?mol-1 | D����25�桢101 kPaʱ��1��������ȫȼ������H2O�ų�����142.9 kJ����2H2O��l��=2H2��g��+O2��g������H=+285.8 kJ?mol-1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com