
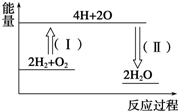
 氢气燃烧生成液态水的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1,请回答下列问题:
氢气燃烧生成液态水的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1,请回答下列问题:分析 ①液态水变成水蒸气需要吸热;
②形成化学键放出能量,反应过程(Ⅱ)代表形成了2mol水,即4molH-O放出的能量.
解答 解:①由2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1可知,2mol氢气完全燃烧生成液态水时放出572kJ的热量,液态水变成水蒸气需要吸热,所以若2mol氢气完全燃烧生成水蒸气,则放出的热量小于572kJ,
故答案为:小于;
②形成化学键放出能量,反应过程(Ⅱ)代表形成了2mol水,即4molH-O放出的能量,因此放出能量为4×463kJ=1852kJ,
故答案为:放出;1852.
点评 本题考查化学反应与能量变化,明确热化学方程式的意义和反应热与键能的关系是解题的关键,题目难度中等.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤经过分馏可得到焦炭、煤焦油和焦炉气 | |
| B. | 石油裂化是为了获得更多的汽油 | |
| C. | 医用酒精的浓度通常为95% | |
| D. | 甲烷、汽油、酒精都是可燃性烃,都可作燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量ZnCl2固体 | B. | 加入少量CuSO4固体 | ||
| C. | 加入少量水 | D. | 用98%的浓硫酸代替稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
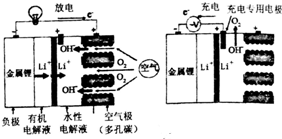
| A. | 充电时,锂离子向阴极移动 | |
| B. | 充电时阴极电极反应式为:Li++e-═Li | |
| C. | 放电时正极电极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 负极区的有机电解液可以换成水性电解液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质的量浓度相等的①NH4Cl②(NH4)2SO4③NH4Al(SO4)2三种溶液中,c(NH4+)由大到小的顺序为:③>②>① | |
| B. | 0.1mol•L-1CH3COOH与0.05mol•L-1NaOH溶液等体积混合(pH<7): c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+) | |
| C. | 0.1mol•L-1Na2CO3与0.05mol•L-1NaHCO3溶液等体积混合: $\frac{3}{5}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 在0.1mol•L-1NaHC2O4溶液(pH<7)中:c(OH-)+2c(C2O42-)=c(H+)+2c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 mol | B. | 3.6 mol | C. | 100 mol | D. | 200 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 方法(或操作) | 原理 |
| A | 分离溶于水中的溴 | 植物油萃取 | 溴在植物油中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 从蛋清中提取蛋白质 | 加入硫酸铜溶液 | 浓盐溶液使蛋白质溶解度降低 |
| D | 尿液中尿糖的检验 | 加入新制Cu(OH)2、加热 | 葡萄糖具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2%H2O2溶液 | 无 |
| ② | 10mL 5%H2O2溶液 | 无 |
| ③ | 10mL 5%H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5%H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
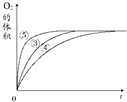 分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
分析该图能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com