
【题目】火药是中国的“四大”发明,由KNO3和两种非金属元素A和B的单质组成,A为黑色固体,B为淡黄色的固体,则下列有关说法中不正确的是( )
A.元素A与N和O同周期,B与O同主族
B.A,B分别与O组成的化合物AO和BO2均是大气的污染物
C.A和B分别与O组成的化合物均能与烧碱反应
D.单质A在一定条件下可与B的最高价氧化物的水化物发生反应
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】下图是某水溶液常温下pH从0到14的范围内H2CO3、HCO3-、CO32-三种成分平衡时组成分数,下列叙述正确的是
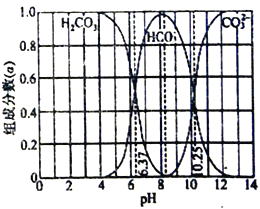
A. 此图是1.0mol/L碳酸钠溶液滴定1.0mol/L盐酸的滴定曲线
B. 向pH=10.25的溶液中通HCl气体使pH=7,此时c(H2CO3)>c(Cl-)=c(HCO3-)>c(CO32-)
C. 人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D. 该温度下,碳酸氢根的水解平衡常数Kh=10-3.75
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需0.5mol/L的Na2CO3溶液970mL和0.5mol/L硫酸溶液250mL.根据这两种溶液的配制情况回答下列问题:
(1)下列仪器使用前必须检查是否漏水的有_________(填序号)。
A.容量瓶 B.蒸馏烧瓶 C.分液漏斗 D.量筒 E.蒸发皿
(2)实验室需0.5mol/L的Na2CO3溶液970mL,现用用Na2CO3·10H2O晶体配制。
①所需仪器除了烧杯、玻璃棒、量筒、托盘天平、药匙外,还缺少_____________、_______________;
根据计算用托盘天平称取Na2CO3·10H2O的质量是_______________ g。
②下图是某同学在实验室配制该溶液的过程图,其中有错误的是______________ (填操作序号)。

(3)某学生欲用质量分数为98%、密度为1.84g/cm3的浓硫酸和蒸馏水配制0.5mol/L硫酸溶液250mL。
①该学生需要用量筒量取________mL上述浓硫酸进行配制。
②配制硫酸溶液时,其正确的操作顺序是B→C → ______→______→____→D。
A.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,轻轻摇动容量瓶
B.用量筒准确量取所需浓硫酸的体积,慢慢沿杯壁注入盛有适量水的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的硫酸沿玻璃棒注入容量瓶中
D.将容量瓶的玻璃塞盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2 cm处
③在配制过程中,下列操作会使所配制的稀硫酸物质的量浓度偏低是__________(填字母序号)。
A.定容时仰视刻度线 B.溶液注入容量瓶前没有恢复到室温就进行定容
C.容量瓶使用前未经干燥 D.用量筒量取浓硫酸时俯视观察凹液面
E. 未将量取浓硫酸的量筒进行洗涤
F.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用0.1000 mol·L-1NaOH溶液滴定20. 00 mL 0.1000 mol·L-1CH3COOH溶液,所得滴定曲线如右图。下列说法正确的是

A. 点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH) +c( H+)
B. 点②所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-)
C. 点③所示溶液中:c(Na+)>c(OH-)> c( CH3COO-) >c( H+)
D. 滴定过程中会出现:c(CH3COOH)>c( CH3COO-)>c(H+) >c( Na+)>c( OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
化学式 | HF | H2CO3 | HClO | H2SO3 |
电离平衡常数(Ka) | Ka=7.2×10-4 | Ka1=4.2×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 | Ka1=1.0×10-2 Ka2=5.0×10-8 |
(1)25℃时,同浓度的HF、H2CO3、HClO三种溶液中,pH最大的是____________(写化学式)。
(2)将0.1mol·L-1的HF溶液1mL加水稀释至10mL(假设温度不变),下列各量增大的是___________(填写字母)。
A.c(H+) B.c(H+)·c(OH-) C.c(H+)/c(HF) D.c(OH-)/c(H+)
(3)25℃时,现有物质的量浓度均为0.1mol·L-1的下列四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液 ④NaClO溶液。
依据数据判断其pH由大到小的顺序是_________________________(填写序号)。
(4)根据H2SO3的电离平衡常数,计算25℃时,0.05mol·L-1Na2SO3溶液的pH=__________。
若某Na2SO3和NaHSO3的混合液呈中性,则溶液中c(SO32-)__________c(HSO3-)(填“大于”、“小于“或“等于")。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
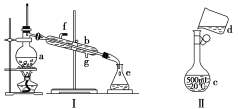
(1)写出下列仪器的名称:
a.________,b.________,c.________。
(2)仪器a~e中,使用前必须检查是否漏水的有________(填序号)。
(3)若利用装置Ⅰ分离四氯化碳和酒精的混合物,温度计水银球的位置在________处。冷凝水由________(填“f”或“g”,下同)口通入,________口流出。
(4)现需配制0.125 mol·L-1 NaOH溶液450 mL,装置Ⅱ是某同学转移溶液的示意图。
①图中的错误是__________________。
除了图中给出的仪器和托盘天平外,为完成实验还需要的仪器有_________________________。
②根据计算得知,需称量NaOH的质量为__________________________g。称量时,往左盘烧杯中逐步添加药品至天平平衡,当只缺少量晶体时,其操作方法是_______________________________。
③下列操作使配制的NaOH溶液浓度偏低的有________。
A.将砝码放在左盘上,NaOH放在右盘上进行称量(使用游码)
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com