
下列各项表达式正确的是 ( )
A. N2的电子式: B.二氧化碳分子的结构式为 O-C-O
B.二氧化碳分子的结构式为 O-C-O
C.NaCl的电子式: D.F - 的结构示意图:
D.F - 的结构示意图:
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
已知:(1)Zn(s)+1/2O2(g)=ZnO(s);△H=-348.3 kJ/mol;
(2)2Ag(s)+1/2O2(g)=Ag2O(s);△H=-31.0 kJ/mol。则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于:
A.-317.3 kJ/mol B.-379.3 kJ/mol
C.-332.8 kJ/mol D.317.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)原子序数小于36的X、 Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素, Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未 成对的电子,w的原子序数为29。回答下列问题:
①Y2X2分子中Y原子轨道的杂化类型为_________,1molY2X2含有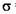 键的数目为____ __________________.
键的数目为____ __________________.
②化合物ZX3的沸点比化台物YX4的高,其主要原因是_____________。
 ③元素Y的一种氧化物与元素z的一种氧化物互为等电子体,元素z的这种氧化物的分子式是_____________。
③元素Y的一种氧化物与元素z的一种氧化物互为等电子体,元素z的这种氧化物的分子式是_____________。
(2)铁元素能形成多种配合物,如:Fe(CO)x
①基态Fe3+的M层电子排布式为___________________________。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为
18.则x=_________。常温下呈液态,熔点为-20.5℃,沸
点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于
(填晶体类型):
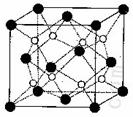
(3)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为_________。已知该晶胞的密度为 g/cm
g/cm ,阿伏加德罗常数为
,阿伏加德罗常数为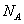 ,求晶胞边长a=________cm。(用含
,求晶胞边长a=________cm。(用含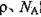 的计算式表示)
的计算式表示)
(4)下列有关的说法正确的是_____________。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为品格能Ca0比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于乙烯和乙烷比较的说法中,不正确的是 ( )
A.乙烯的结构简式为CH2CH2,乙烷的结构简式为CH3CH3
B.乙烯分子中所有原子处于同一平面上,乙烷分子则为立体结构,原子不都在同一平面上
C.乙烯分子中含有碳碳双键,乙烷分子中含有碳碳单键,双键不如单键稳定,导致乙烯的性质比乙烷活泼
D.乙烯分子中因含有不饱和键,导致乙烯能使酸性KMnO4溶液和溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
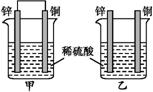
将相同表面积的纯锌片和纯铜片按图示方式插入同浓度的稀硫酸
中一段时间,下列叙述正确的是( )
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.甲中铜被氧化,乙中锌被氧化
D.产生气泡的速率甲比乙大
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C都是金属,把A浸入C的盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极。A、B、C金属的活动性顺序为 ( )
A.B>A>C B.A>C>B C.A>B>C D.B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属的工业制法中正确的是 ( )
A.制钛:用金属钠置换四氯化钛(TiCl4)溶液中的钛
B.炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中铁的氧化物
C.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
D.炼铜:用黄铜矿经电解精炼得到纯度为99.9%的铜
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25 ℃)
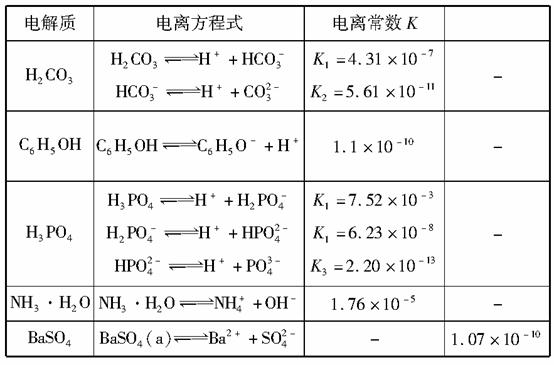
回答下列问题:
(1)写出C6H5OH与Na3PO4反应的离子方程式:__________。
(2)25 ℃时,向10 mL 0.01 mol·L-1 C6H5OH溶液中滴加V mL 0.01 mol·L-1氨水,混合溶液中粒子浓度关系正确的是________(填序号)。
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3·H2O)+2c(NH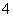 )=c(C6H5O-)+c(C6H5OH)
)=c(C6H5O-)+c(C6H5OH)
c.V=10时,混合液中水的电离程度小于0.01 mol·L-1 C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH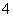 )>c(C6H5O-)>c(H+)>c(OH-)
)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kh表示),类比化学平衡常数的定义。25 ℃时,Na2CO3第一步水解反应的水解常数Kh=________mol·L-1。
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大)。
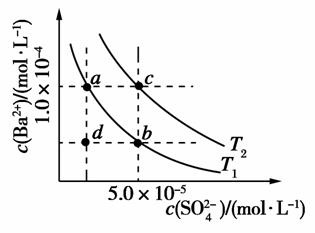
①T2________25℃(填“>”、“<”或“=”)。
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是________(填序号)。
a.加入Na2SO4不能使溶液a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com