
| A. | 水晶和干冰的熔化 | B. | 食盐和冰醋酸熔化 | ||
| C. | 液溴和液汞的气化 | D. | 纯碱和烧碱的熔化 |
分析 首先判断晶体类型,分子晶体中存在分子间作用力,离子晶体中存在离子键,原子晶体中存在共价键,金属晶体中存在金属键,以此解答该题.
解答 解:A.水晶为原子晶体,融化克服共价键,干冰为分子晶体,融化克服分子间作用力,故A不选;
B.NaCl是离子晶体,熔融时破坏离子键,冰醋酸属于分子晶体,融化克服分子间作用力,故B不选;
C.液溴和液汞的气化分别克服分子间作用力和金属键,故C不选;
D.纯碱和烧碱都属于离子晶体,熔化克服离子键,故D选.
故选D.
点评 本题考查分子间作用力以及晶体的类型的判断,为高频考点,侧重于学生的分析和基本概念的综合理解和运用的考查,难度不大,注意相关基础知识的积累.


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 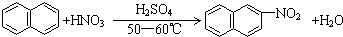 | |
| B. | CH3CH2CH2CHOHCH3$→_{△}^{浓硫酸}$CH3CH2CH=CHCH3+H2O | |
| C. | 2CH3CH2OH$→_{140℃}^{浓H_{2}SO_{4}}$CH3CH2OCH2CH3+H2O | |
| D. | CH3COOH+CH3OH $→_{△}^{浓H_{2}SO_{4}}$ CH3COOCH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
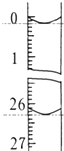 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.15 |
| 第二次 | 25.00 | 0.56 | 30.30 |
| 第三次 | 25.00 | 0.20 | 26.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表分为7个主族、7个副族、1个0族、1个VIII族,共18个纵行 | |
| B. | 己知As元素位于第四周期VA族,故NH3比 AsH3稳定 | |
| C. | 已知Sr元素位于第五周期IIA族,故Sr(OH)2碱性比Mg(OH)2弱 | |
| D. | 副族元素中没有非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
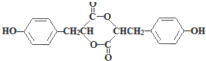 )的路线如下图所示:
)的路线如下图所示: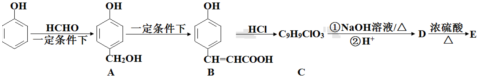
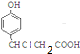 +3NaOH$\stackrel{△}{→}$$\stackrel{△}{→}$$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$$\stackrel{△}{→}$$\stackrel{△}{→}$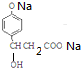 +NaCl+2H2O;
+NaCl+2H2O; 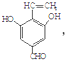 ,写出其余的同分异构体的结构简式
,写出其余的同分异构体的结构简式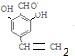 、
、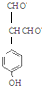 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中均存在共价键 | |
| B. | 晶体结构相似的原子晶体,共价键越弱,熔点越低 | |
| C. | 晶体在受热熔化过程中一定存在化学键的断裂 | |
| D. | 原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v=0.10 mol•L-1•s-1是指1 s内某物质的物质的量浓度为0.10 mol•L-1 | |
| B. | 对于任何化学反应来说,反应速率越快,反应现象就越明显 | |
| C. | 化学反应速率只是对可逆反应才适用 | |
| D. | 根据反应速率的大小,可以知道反应进行的相对快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期 族 | I | II | III | IV | V | VI | VII | O |
| 二 | C | F | ||||||
| 三 | Na | Mg | Al | Si | S | Cl | Ar |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com