
下列分子或离子在指定的分散系中能大量共存的一组是( )
A.银氨溶液:Na+、K+、NO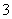 、NH3·H2O
、NH3·H2O
B.空气:C2H2、CO2、SO2、NO
C.氢氧化铁胶体:H+、K+、S2-、Br-
D.高锰酸钾溶液:H+、Na+、SO 、葡萄糖分子
、葡萄糖分子
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
(1)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
①黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,氧化产物为________,若有3 mol FeS2参加反应,转移________mol电子。
6SO2+Fe3O4,氧化产物为________,若有3 mol FeS2参加反应,转移________mol电子。
②与明矾相似,硫酸铁也可用作净水剂,其原理为_______________________________
____________(用离子方程式表示)。
③FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为____________________。
(2)已知:S2O 有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为
有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为
S2O +2I-===2SO
+2I-===2SO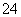 +I2①
+I2①
I2+2S2O ===2I-+S4O
===2I-+S4O ②
②
S2O 、S4O
、S4O 、I2氧化性强弱顺序:______________________。
、I2氧化性强弱顺序:______________________。
(3)已知溶液中,还原性为HSO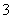 >I-,氧化性为IO
>I-,氧化性为IO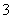 >I2>SO
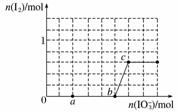
>I2>SO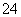 。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。
。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。
①a点处的还原产物是__________(填离子符号);
b点→c点反应的离子方程式是_________________________________。
②当溶液中的I-为0.5 mol时,加入的KIO3可能是________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍—磷合金。
化学镀镍的溶液中含有Ni2+和H2PO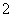 ,在酸性条件下发生以下镀镍反应:
,在酸性条件下发生以下镀镍反应:
Ni2++____H2PO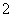 +__________—→____Ni+____H2PO
+__________—→____Ni+____H2PO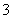 +__________
+__________
①请配平上述化学方程式。
②上述反应中,若生成1 mol H2PO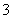 ,反应中转移电子的物质的量为________。
,反应中转移电子的物质的量为________。
(2)①高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑
若生成2 mol Na2FeO4,则反应中电子转移的物质的量为________mol。
②高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含Mn2+1 mg的水体样本,需要1.2 mg·L-1高铁酸钾________ L。
(3)S2O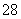 具有强氧化性,其还原产物为SO
具有强氧化性,其还原产物为SO ,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。请写出此反应的化学方程式:________________________________________________________________________。
,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。请写出此反应的化学方程式:________________________________________________________________________。
(4)①在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请配平该化学方程式:
FeSO4+____KNO3+____H2SO4—→____K2SO4+____Fe2(SO4)3+____NO↑+____H2O;其中氧化剂为__________。
②铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160 mL 5 mol·L-1盐酸中,在加入一定量铁粉恰好溶解,收集到2.24 L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH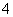 、Cl-、S2-
、Cl-、S2-
B.酸性溶液中可能大量存在Na+、ClO-、SO 、I-
、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO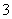
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液可能含有Cl-、SO 、CO
、CO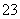 、NH
、NH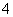 、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中 ( )
、Fe3+、Al3+和K+。取该溶液100 mL,加入过量NaOH溶液,加热,得到0.02 mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6 g固体;向上述滤液中加足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。由此可知原溶液中 ( )
A.至少存在5种离子
B.Cl-一定存在,且c(Cl-)≥0.4 mol·L-1
C.SO 、NH
、NH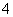 一定存在,Cl-可能不存在
一定存在,Cl-可能不存在
D.CO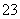 、Al3+一定不存在,K+可能存在
、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.在强碱性溶液中:Na+、K+、AlO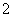 、Cl-
、Cl-
B.pH=1的溶液中:HCO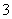 、NH
、NH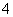 、NO
、NO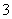 、Ca2+
、Ca2+
C.无色溶液中:Cu2+、NO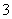 、Cl-、H+
、Cl-、H+
D.无色溶液中:Na+、K+、ClO-、SO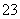
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
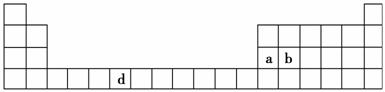
(1)请写出元素d的基态原子电子排布式________________________________________________________________________。
(2)b元素的氧化物中b与氧元素之间的共价键类型是________。其中b原子的杂化方式是________。
(3)a单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
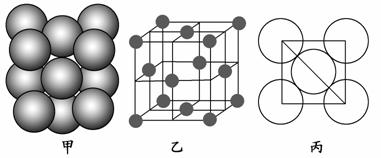
若已知a的原子半径为d,NA代表阿伏加德罗常数,a的相对原子质量为Mr,则一个晶胞中a原子的数目为________,该晶体的密度为________(用字母表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com