
| A. | 常温常压下,18g重水(D2O)所含的中子数为10NA | |
| B. | 100℃时,1LpH=1的硫酸溶液中,含有0.2NA个H+ | |
| C. | 71g氯气发生氧化还原反应,一定失去2NA个电子 | |
| D. | 室温下,14gN2和CO的混合气体中含有的原子数目为NA |
分析 A、求出重水的物质的量,然后根据重水中含10个中子来分析;
B、pH=1的硫酸溶液中,氢离子浓度为0.1mol/L;
C、氯气反应后的价态不明确来分析;
D、氮气和CO的摩尔质量均为28g/mol,且均为双原子分子.
解答 解:A、18g重水的物质的量为0.9mol,而重水中含10个中子,故0.9mol重水中含9NA个中子,故A错误;
B、pH=1的硫酸溶液中,氢离子浓度为0.1mol/L,故1L溶液中含有的氢离子的物质的量为0.1mol,个数为0.1NA个,故B错误;
C、氯气反应后的价态不明确,故71g氯气即1mol氯气反应后转移的电子数无法计算,故C错误;
D、氮气和CO的摩尔质量均为28g/mol,故14g混合物的物质的量为0.5mol,且均为双原子分子,故0.5mol混合物中含NA个原子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:实验题
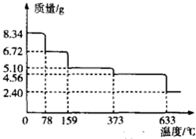 铁及其化合物在工农业生产、科学研究等方面具有广泛用途.回答下列问题:
铁及其化合物在工农业生产、科学研究等方面具有广泛用途.回答下列问题:| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | x | Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
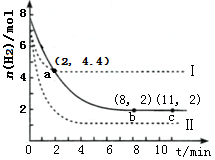 某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )
某温度下,将6mol CO2和8mol H2 充入2L密闭容器中发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0,容器中H2的物质的量随时间的变化关系如图中的实线所示.图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化关系.下列说法正确的是( )| A. | 从反应开始至a 点,ν(CO2)=0.9 mol•L-1•min-1 | |
| B. | 曲线Ⅰ对应的条件改变可能是减小压强 | |
| C. | 曲线Ⅱ对应的条件改变可能是充入氢气 | |
| D. | 该温度下,此反应的化学平衡常数的数值为0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | NaCl只有在水溶液中才能电离出Na+、Cl- | |
| C. | 能与酸反应的氧化物,不一定是碱性氧化物 | |
| D. | 电离时能产生H+的化合物是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 药名 | 胃舒平 | 达喜 |
| 有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相对分子质量 | 78 | 530 |
| 每片含有效成分的药量 | 0.245g | 0.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
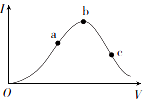 一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.
一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | 阴离子 | ||
| OH- | SO42- | SO32- | |
| Ca2+ | ① | 微 | 不 |
| Fe3+ | 不 | 溶 | ② |
| Cu2+ | 不 | ③ | 不 |
| A. | ①处物质属于可溶性碱 | |
| B. | ②处物质组成为Fe2(SO3)3 | |
| C. | ③处物质为硫酸盐或者铜盐 | |
| D. | ①、③处物质在溶液中发生的反应一定是Cu2++2OH-═Cu(OH)2↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com