
【题目】下列有关说法正确的是
A. 标准状况下,6. 72 L NO2与水反应转移的电子数为0.1NA
B. 1 L 0.1 mol/L的碳酸钠溶液中的阴离子总数等于0.1NA
C. 1 mol Cl2与足量 Fe反应转移电子数一定为3NA
D. 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ. 硒化锌是一种透明半导体,也可作为红外光学材料,熔点是1 520 ℃。
(1)基态锌原子的价电子排布式是_______。
(2)根据元素周期律,电负性Se____S,第一电离能Se____As(填“>”或“<”)。
(3)H2Se的分子构型是____,其中硒原子的杂化轨道类型是____。
(4)H2O的沸点高于H2Se的沸点(-42 ℃),其原因是________________。
(5)晶体Zn为六方最密堆积,其配位数是____。
Ⅱ 氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)C、N、O三种元素第一电离能从大到小的顺序是________。
(2)1 mol N2F2含有____ mol σ键。
(3)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4含____ mol配位键。
(4)安全气囊打开时发生的化学反应为10NaN3+2KNO3 = K2O+5Na2O+16N2↑。
①写出与N2互为等电子体的分子________。
②Na2O的晶胞结构如图所示,晶胞边长为566 pm,晶胞中氧原子的配位数为____,Na2O晶体的密度为______(只要求列算式,不必计算出结果),Na+ 与O2-间的最短距离为_____pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内含量较少,但对维持生物体正常生命活动必不可少的元素是( )
A. Fe、Mn、Zn、Mg B. Zn、Cu、Mn、Ca
C. Zn、Cu、B、Mn D. Mg、Mn、Cu、Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对增生性瘢痕早期进行 ![]() Sr(锶)干预可取得较好效果.下列说法正确的是( )
Sr(锶)干预可取得较好效果.下列说法正确的是( )
A.Sr为于第4周期ⅡA 族
B.![]() Sr核内中子数与质子数之差为14
Sr核内中子数与质子数之差为14
C.![]() Sr与
Sr与 ![]() Y互为同位素
Y互为同位素
D.![]() Sr的核内质子数为38,Sr元素的相对原子质量为90
Sr的核内质子数为38,Sr元素的相对原子质量为90
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO3-+5I-+3H2O,下列说法不正确的是( )
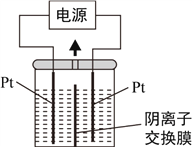
A. 右侧发生的电极方程式:2H++2e-=H2↑
B. 电解结束时,右侧溶液中含有IO3-
C. 电解槽内发生反应的总化学方程式KI+3H2O=KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。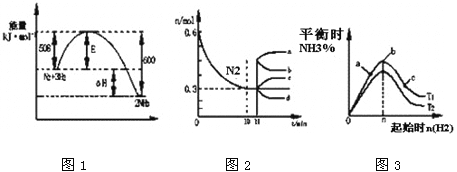
下列说法正确的是
A. 该反应为自发反应,由图1可得加入适当的催化剂,E和△H都减小
B. 图2中0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d
C. 图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点
D. 图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关化学反应的说法,正确的是
A. 自发反应都是放热反应B. 自发反应都是熵增大的反应
C. 自发反应一定能实现D. 非自发反应在一定条件下能实现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com