
| 水解反应 | 平衡常数(K) |
Fe3+ + 3H2O  Fe(OH)3 + 3H+ Fe(OH)3 + 3H+ | 7.9 × 10-4 |
Fe2+ + 2H2O  Fe(OH)2 + 2H+ Fe(OH)2 + 2H+ | 3.2 × 10-10 |
Cu2+ + 2H2O  Cu(OH)2 + 2H+ Cu(OH)2 + 2H+ | 3.2 × 10-7 |
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色, pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化。 |


科目:高中化学 来源:不详 题型:单选题
A.Na2S的电子式: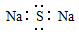 |
B.质子数为53,中子数为78的碘原子: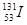 |
C.S2-的结构示意图: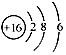 |
D.HOCH2COOH缩聚物的结构简式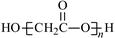 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:1:1 | B.3:2:1 | C.1:2:3 | D.2:3:6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.2mol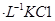 溶液与lmol 溶液与lmol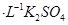 溶液混合后, 溶液混合后,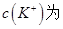 2mol 2mol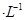 |
| B.120gNaC1溶液中溶有20gNaCl,该温度下NaC1的溶解度为20g |
C.22.4LHCl气体溶于水制成1L溶液,该溶液的物质的量浓度为lmol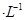 |
D.把5g胆矾(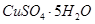 )溶于45g水中,所得溶液溶质的质量分数为10% )溶于45g水中,所得溶液溶质的质量分数为10% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.解毒时美蓝表现氧化性 | B.中毒时亚硝酸盐发生氧化反应 |
| C.解毒时高铁血红蛋白被还原 | D.中毒过程中血红蛋白显氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将58.5 g NaCl溶于1 L水中可得1 mol·L-1的NaCl溶液 |
| B.将标准状况下22.4 L HCl溶于1 L水中可得1 mol·L-1盐酸 |
| C.将25.0 g胆矾溶于水后配成100 mL溶液所得溶液浓度为1 mol·L-1 |
| D.将78 g Na2O2溶于水,配成1 L溶液可得到浓度为1 mol·L-1溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.KI溶液, | B.淀粉溶液, | C.NaOH溶液, | D.氯水。发现溶液颜色按下面次序变化: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com