
 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系.
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系.
分析 短周期元素中,X、R最外层电子数均为6,处于ⅥA族,X的原子序数较小,故X为O元素、R为S元素;Y、W最外层电子数均为7,Y的原子序数较小,故Y为F元素、W为Cl元素;Z最外层电子数为1,处于IA族,原子序数大于氟,故Z为Na元素;Q最外层电子数为4,处于ⅣA族,其原子序数大于Na,则Q为Si元素;P的最外层电子数为5,原子序数大于Si,则P为P,据此进行解答.
解答 解:由最外层电子数与原子序数关系可知,X、Y处于第二周期,X的最外层电子数为6,故X为O元素,Y的最外层电子数为7,故Y为F元素;Z、P、Q、R、W处于第三周期,最外层电子数分别为1、4、5、6、7,故Z为Na元素、Q为Si、P为P元素、R为S、W为Cl元素,
(1)O,S,Cl的气态氢化物分别为:H2O、H2S、HCl,水呈中性、HCl为强酸,故水溶液酸性大小顺序为:HCl>H2S>H2O,
故答案为:HCl>H2S>H2O;
(2)O、Na的单质按物质的量比1:2反应生成的化合物为过氧化钠,过氧化钠中化学键类型有离子键、共价键,2mol过氧化钠与标准状况下1.5molCO2和1.0mol水蒸气混合物充分反应,反应方程式为:2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,据此关系式得出:1.5molCO2和1.0mol物质的量大于过氧化钠的物质的量,且每1mol过氧化钠反应转移1mol电子,由于过氧化钠不足,故转移电子的物质的量是2mol×1=2mol,转移电子的数目为2NA或1.204×1024,
故答案为:离子键、非极性键;2NA或1.204×1024;
(3)Si单质与Na的最高氧化物对应水化物(NaOH)的浓溶液反应生成硅酸钠和氢气,化学方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑,
故答案为:Si+2NaOH+H2O=Na2SiO3+2H2↑;
(4)反应Ⅰ为吸热反应,反应Ⅱ为放热反应,则A、C错误,因为两图中生成物总能量高于反应物总能量,由题意知:反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则反应Ⅱ的活化能较大,则B错误、D正确;
故答案为:D.
点评 本题考查结构性质位置关系、元素周期律等知识,题目难度中等,根据最外层电子数及原子序数的关系确定元素是解题的关键,注意掌握元素周期表结构及元素周期律内容.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:解答题
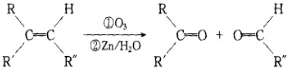
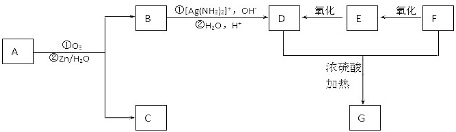
 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏实验时,应将温度计水银球置于蒸馏烧瓶支管口处 | |
| B. | 蒸馏实验时,冷水从冷凝管下口入,上口出 | |
| C. | 萃取使用的主要仪器是分液漏斗,在使用前要先检验其是否漏液 | |
| D. | 萃取实验时,应先后将上下两层液体从下口放出,并用不同烧杯盛放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CF4 CBr4 CsCl SiO2 | B. | SiO2 CsCl CF4 CBr4 | ||
| C. | CsCl SiO2 CBr4 CF4 | D. | SiO2 CsCl CBr4 CF4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室常用以下方法制取氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O,
实验室常用以下方法制取氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl2+Cl2↑+2H2O, .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 0.3mol | C. | 0.2mol | D. | 0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3═Na2++CO32- | B. | NaHCO3═Na++HCO3- | ||
| C. | KClO3═K++Cl-+3O 2- | D. | H2SO4═H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com