
| A. | ①③⑤ | B. | ①④⑤ | C. | ③④⑤ | D. | ①②④ |
分析 氨水中存在下列平衡:NH3+H2O?NH3•H2O?NH4++OH-,加水促进电离,且如果加入能和铵根离子或氢氧根离子反应的物质,平衡就向电离方向移动,如果加入的物质中含有铵根离子或氢氧根离子,平衡向逆反应方向移动,以此解答该题.
解答 解:①加NH4Cl固体,溶液中铵根离子浓度增大,平衡向逆反应方向移动,故①错误;
②加NaOH溶液,溶液中氢氧根离子浓度增大,平衡向逆反应方向移动,故②错误;
③加HCl,氢离子和氢氧根离子反应,导致平衡向右移动,故③正确;
④加CH3COOH溶液,氢离子和氢氧根离子反应,导致平衡向右移动,故④正确;
⑤加水促进电离,故⑤正确;
故选C.
点评 本题考查了弱电解质的电离,为高频考点,注意把握影响弱电解质电离的因素,难度中等,注意加水稀释氨水电离平衡的移动,注意相关基础知识的积累.


科目:高中化学 来源: 题型:选择题
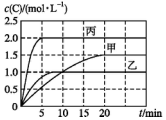 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间的变化关系分别以表和图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间的变化关系分别以表和图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | 1.0 L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5 mol A 0.5 mol B | 1.5 mol A 0.5 mol B | 6.0 mol A 2.0 mol B |
| A. | 10 min内甲容器中反应的平均速率v(A)=0.025 mol•L-1•min-1 | |
| B. | 由图可知:T1<T2,该反应为吸热反应 | |
| C. | x=1,若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T2℃时,丙容器比乙容器反应快的原因是使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5 mol•L-l•min-l | B. | v(B)=0.6 mol•L-l•min-l | ||
| C. | v(C)=0.35 mol•L-l•min-l | D. | v(D)=0.4 mol•L-l•min-l |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:P<S<Cl | B. | 非金属性:P>S>Cl | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 稳定性:PH3>H2S>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将电能转化为化学能的装置 | |
| B. | 手机所用的锂离子电池属于一次电池 | |
| C. | 可将反应2FeCl3+Cu=2FeCl2+CuCl2设计为原电池 | |
| D. | 铜、锌、稀硫酸原电池工作时,电子通过导线由Cu→Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com