
从经济利益和环境保护考虑,大量制取硝酸铜最宜采用的方法是( )
A.Cu+AgNO3Cu(NO3)2
B.Cu+HNO3(稀)Cu(NO3)2
C.Cu+HNO3(浓)Cu(NO3)2
D.Cu CuO
CuO Cu(NO3)2
Cu(NO3)2
科目:高中化学 来源: 题型:
下列有关煤、石油、天然气等资源的说法正确的是
( )
A.石油裂解得到的汽油是纯净物
B.石油产品都可发生加成反应
C.天然气是一种清洁的化石燃料
D.煤就是碳,属于单质
查看答案和解析>>
科目:高中化学 来源: 题型:
体积不相同的三个烧瓶中分别盛满了NH3、HCl和NO2,将它们倒扣在水槽中充分溶解后,塞住瓶口取出,烧瓶内三溶液物质的量浓度之比为( )
A.1∶1∶1 B.2∶2∶3
C.3∶3∶2 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
在空气中加热S粉和Fe粉的混合物,可观察到下列现象,请写出有关反应方程式。
(1)有淡蓝色火焰,且生成刺激性气味的气体________________________________。
(2)混合粉末变红,放出热量,最后变为黑色固体________________________________。
(3)不时有火星从混合物中射出______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将相同质量的铜分别与过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.反应速率:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
查看答案和解析>>
科目:高中化学 来源: 题型:
装置Ⅰ和装置Ⅱ、装置Ⅲ是有关硝酸和铜反应的实验装置示意图:
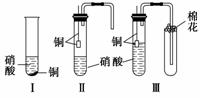
(1)若用装置Ⅰ进行铜与浓硝酸反应的实验,最大的缺点是____________________;
若用装置Ⅰ来证明铜与稀硝酸反应生成NO气体,其最大缺点是不能与浓硝酸跟铜反应形成鲜明对照。简述原因_____________________________________________________。
(2)若用装置Ⅱ进行适当操作,即可克服上述缺点,还能使上述两反应在同一试管中先后连续进行。实验步骤如下:
步骤一:组装好装置并______________后,加入2 mL浓硝酸(铜片接近酸液),塞紧胶塞。
步骤二:________________(操作)使反应发生。当导管口有少量红棕色气体逸出时,__________________________________________(操作)使反应停止。同时将导管插入水中。稍后能观察到:a.水沿导管倒吸至试管中;还可能观察到下列________(填序号)等明显现象;b.溶液由蓝色变为无色;c.铜片表面产生气泡;d.红棕色气体变为无色。请解释产生现象a的原因________________________________________________________________________
________________________________________________________________________。
步骤三:当试管中溶液体积约占试管容积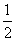 时,此时铜片与溶液接触,从水中抽出导管,并伸入一试管中,管口塞上浸有浓碱液的棉花(如装置Ⅲ)。这样做的目的是_______和__________________。
时,此时铜片与溶液接触,从水中抽出导管,并伸入一试管中,管口塞上浸有浓碱液的棉花(如装置Ⅲ)。这样做的目的是_______和__________________。
步骤四:反应完毕后……
(3)上述实验“步骤四”中反应完毕后还需要进行的操作是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是四种盐在不同温度下的溶解度(g/100g水)
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
(计算时假定:①盐类共存时不影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计)
取23.4 g NaCl和40.4 g KNO3,加70.0 g H2O,加热溶解,在100℃时蒸发掉50.0 g H2O,维持该温度,过滤析出晶体。计算所得晶体的质量(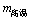 );将滤液冷却到10℃,待充分结晶后、过滤,计算所得晶体的质量(
);将滤液冷却到10℃,待充分结晶后、过滤,计算所得晶体的质量(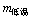 )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的铁粉和硫粉的混合物共热,充分反应后冷却再加入足量稀硫酸,得到标准状况下的气体11.2 L,则原混合物可能的组成是n代表物质的量
A.n(Fe)<n(S)总质量等于44 g
B.n(Fe)> n(S)总质量等于44 g
n(S)总质量等于44 g
C.n(Fe)=n(S)总质量大于44 g
D.n(Fe)>n(S)总质量小于44 g
查看答案和解析>>
科目:高中化学 来源: 题型:
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。
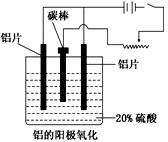 (1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的
(1)工业上采用电解氧化铝和冰晶石(Na3AlF6)熔融体的
方法冶炼得到金属铝:2Al2O3 4Al+3O2↑。
4Al+3O2↑。
加入冰晶石的作用为_______________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,
可用电解方法进一步提纯,该电解池中阳极的电极
反应式为________,下列可作阴极材料的是______。
a.铝材 b.石墨 c.铅板 d.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为_______________________。在铝阳极氧化过程中,需要不断地调整电压,理由是_________________。
(4)下列说法正确的是__________________。
a.阳极氧化是应用原电池原理进行金属材料表面处理的技术
b.铝的阳极氧化可增强铝表面的绝缘性能
c.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
d.铝的阳极氧化膜富多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com