
把19.2 g 的Cu放入足量的稀硝酸中,微热至Cu完全反应。
已知:3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO↑+ 4H2O求:
(1)参加反应的硝酸的物质的量;
(2)被还原的硝酸的质量;
(3)生成的NO在标准状况下的体积。
(1)0.8mol (2)12.6g (3)4.48L
解析试题分析:19.2g 的Cu的物质的量为 =0.3mol,
=0.3mol,
(1)设参加反应的硝酸的物质的量为x
3Cu+8HNO3(稀)=3Cu(NO3)2 +2NO↑+4H2O
3mol 8mol
0.3mol x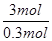 =
=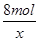
x=0.8mol,
答案:参加反应的硝酸的物质的量为0.8mol.
(2)由方程式可以看出,硝酸没有全部被还原,当有8mol硝酸反应时,有2mol被还原,
则0.8mol硝酸参加反应,被还原的硝酸的物质的量为0.2mol,质量为:0.2mol×63g·mol-1=12.6g.答案:12.6g;
(3)设产生的NO在标准状况下的体积为V,则
3Cu+8HNO3(稀)=3Cu(NO3)2 +2NO↑+4H2O
3mol 44.8L
0.3mol V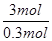 =
=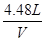
V=4.48L,
答案:产生的NO在标准状况下的体积为4.48L
考点:化学方程式的有关计算


科目:高中化学 来源: 题型:填空题
水是组成生命体的重要物质,有关水的反应实例有很多。
(1)有人设想将太阳能转化为电能,进而将水电解生成氢气,氢气是一种清洁能源。请分析电解水的过程中,水是_____________(填仅被氧化,仅被还原,既被氧化又被还原,既不被氧化又不被还原)
(2)野营爱好者携带氢化钙固体作为生氢剂,方程式为CaH2+2H2O=Ca(OH)2+2H2↑,其中水是_____________(填仅被氧化,仅被还原,既被氧化又被还原,既不被氧化又不被还原)
(3)在下列反应中水只被还原的是_____________(填序号)
| A.C+H2O=CO+H2 | B.CaO+H2O=Ca(OH)2 |
| C.3Fe+4H2O=Fe3O4+4H2 | D.3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有:Al2O3.C.N2.AlN.CO
(1)请将AlN之外的反应物与生成物分别填入以下空格内,配平,并标出电子转移的方向和数目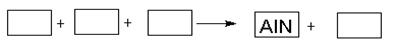
(2)若反应中共转移3.01 ×1023个电子,则该反应产生气体的体积为: (标准状况下)
(3)氮化铝也能由氯化铝与氨气经气相反应制得:AlCl3+NH3  AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
A.前一方法中的 Al2O3.C.N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.前一方法中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
2013年初,雾霾天气多次肆虐我国中东部,该地区PM2.5严重超标。研究表明,PM2.5约60%来源于某些气体污染物在空气中转变而成的二次颗粒物。这些气体污染物主要有二氧化硫、氮氧化物、氨气、挥发性有机物。因此,控制、治理PM2.5污染源成为环保的重要课题。
(1)研究表明,TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,如图所示,OH与NO2的反应为NO2+OH HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是 。
HNO3。写出OH与NO反应的化学方程式:_____________,该反应中被氧化的元素是 。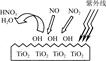
(2)如图所示的电解装置能吸收和转化NO2、NO和SO2。阴极排出的溶液中含S2O42-离子,能吸收NOx气体,生成的SO32-可在阴极区再生。请将S2O42-吸收NO2的离子方程式配平,并标明电子转移的方向和数目。
____S2O42-+____NO2+____OH- SO32-+____N2+____
SO32-+____N2+____
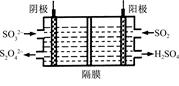
(3)已知上述电解装置阳极反应为:SO2-2e-+2H2O SO42-+4H+,阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为 。
SO42-+4H+,阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为 。
(4)PM2.5产生的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,大多含有重金属等有毒物质。一般而言,粒径2.5微米至10微米的粗颗粒物主要来自扬尘等;2.5微米以下的细颗粒物(PM2.5)则主要来自化石燃料的燃烧(如机动车尾气、燃煤)、挥发性有机物的排放等。请你结合信息,给出降低PM2.5排放的对策(至少两条): ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
铁及其化合物之间的相互转化可用下式表示:
回答下列有关问题:
(1)铁元素位于元素周期表的第四周期第Ⅷ族,原子序数是26,最外层有2个电子。元素铁的原子结构示意图是 。
(2)检验硫酸铁溶液中是否存在Fe2+的方法是
(3)
(4)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾强,其本身在反应中被还原为Fe3+。Na2FeO4之所以能净水,除了能消毒杀菌外,另一个原因是(结合离子方程式说明) 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将25.6g铜与含0.3molH2SO4的浓硫酸充分反应,(1)若在反应过程中消耗了0.2mol的H2SO4,则生成的气体标况下体积为多少?(2)若以上反应产生的气体全部逸出后,继续在剩余物质中加入2mol/L的稀硝酸100ml,充分反应后产生NO的物质的量为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将高碘酸H5IO6加入MnSO4溶液中可使溶液呈紫红色,已知H5IO6在反应中发生如下过程:H5IO6→HIO3。完成下列填空:
(1)将该反应的氧化剂、还原剂及配平后的系数填入正确位置。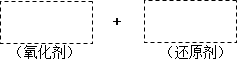
(2)在上图中标明电子转移的方向和数目。
(3)若向H5IO6溶液中加入足量的下列物质,能将碘元素还原成碘离子的是____(选填序号)。
a. 盐酸 b. 硫化氢 c. 溴化钠 d. 硫酸亚铁
(4)若向含1mol H5IO6的溶液中加入过量的过氧化氢溶液,再加入淀粉溶液,溶液变蓝,同时有大量气体产生。请写出此反应的化学方程式:________________________________,此过程中至少可得到气体_________L(标准状态下)。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。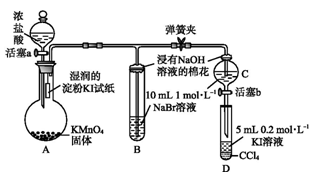
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)A中产生黄绿色气体,其化学方程式是 。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)B中溶液发生反应的离子方程式是 。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 。
(5)过程Ⅲ实验的目的是 。
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 ,得电子能力逐渐减弱。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
25℃、101kPa下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s) △H2=-511kJ·mol-1
下列说法正确的是( )
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa下,Na2O2(s)+2Na(s)=2Na2O(s) △H=-317kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com