
在一个容积固定为2 L的密闭容器中,发生反应:aA(g)+bB(g) pC(g) ΔH=?反应情况记录如下表:
pC(g) ΔH=?反应情况记录如下表:
| 时间 | c(A)/mol·L-1 | c(B)/mol·L-1 | c(C)/mol·L-1 |
| 0 min | 1 | 3 | 0 |
| 第2 min | 0.8 | 2.6 | 0.4 |
| 第4 min | 0.4 | 1.8 | 1.2 |
| 第6 min | 0.4 | 1.8 | 1.2 |
| 第8 min | 0.1 | 2.0 | 1.8 |
| 第9 min | 0.05 | 1.9 | 0.3 |
请仔细分析,根据表中数据,回答下列问题:
(1)第2 min到第4 min内A的平均反应速率v(A)=______mol·L-1·min-1。
(2)由表中数据可知反应在第4 min到第6 min时处于平衡状态,若在第2 min、第6 min、第8 min时分别改变了某一反应条件,则改变的条件分别可能是:
①第2 min_________________或________________;
②第6 min_________________;
③第8 min_________________。
(3)若从开始到第4 min建立平衡时反应放出的热量为235.92 kJ,则该反应的ΔH=__________________。
(1)v(A)=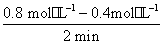 =0.2 mol·L-1·min-1
=0.2 mol·L-1·min-1
(2)①从2 min~4 min来看,A、B、C的浓度变化量比前2 min大,说明反应速率加快了,故2 min时改变的条件可能为使用催化剂或升高温度。
②第6 min改变条件后,达到第8 min时,作为反应物,A的浓度减少而B的浓度增加,可知改变的条件为增加B的浓度。
③从0~2 min来看,A、B、C的浓度变化量分别为0.2 mol·L-1、0.4 mol·L-1、0.4 mol·L-1可知a、b、p分别为1、2、2。从第9 min的数据来看,C的浓度大幅度减小,而A、B浓度也减小,且减小量与方程式中化学计量数成正比,可知第8 min改变的条件为减小C的浓度。
(3)从开始到第4 min消耗A 1.2 mol,共放出热量235.92 kJ,故每消耗1 mol A放出热量: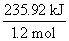 =196.6 kJ·mol-1,由(2)的分析可知A的化学计量数为1,故该反应的ΔH=-196.6 kJ·mol-1。
=196.6 kJ·mol-1,由(2)的分析可知A的化学计量数为1,故该反应的ΔH=-196.6 kJ·mol-1。
答案:(1)0.2 (2)①使用催化剂 升高温度
②增加B的浓度 ③减小C的浓度
(3)-196.6 kJ·mol-1


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某校化学研究性学习小组设计如下实验方案,测定放置已久的小苏打样品中纯碱的质量分数。
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称取剩余固体质量,计算。实验中加热至恒重的目的是 。
(2)方案二:按下图装置进行实验。并回答以下问题。
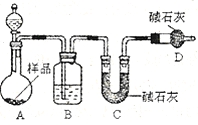
① 实验前先 。分液漏斗中应该装 (“盐酸”或“硫酸”)。D装置的作用是 。
② 实验中除称量样品质量外,还需称 装置前后质量的变化。
③ 根据此实验得到的数据,测定结果有误差。因为实验装置还存在一个明显缺陷,该缺陷是 。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液。过滤洗涤,干燥沉淀,称量固体质量,计算:
① 过滤操作中,除了烧杯,漏斗外,还用到的玻璃仪器有 。
② 实验中判断沉淀是否完全的方法是 。
③ 已知称得样品21.2g,干燥的沉淀质量为19.7g,则样品中碳酸钠的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.pH=3的酸溶液稀释100倍后pH=5
B.在相同温度下,pH=3的溶液和pH=5的溶液相比,前者氢离子浓度是后者的
100倍
C.相同温度相同浓度的钾盐溶液中,酸式盐的pH一定等于正盐的pH
D.碳酸钠溶液在室温时的pH一定大于60℃时的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
已知元素X、Y的原子最外层分别有n个和(m-5)个电子,次外层分别有(n+2)个和m个电子,据此推断:
(1)元素X和Y分别是________和________(填元素符号);其电子排布式分别为_________和_________;其价电子的电子排布图分别为_________和_________。
(2)这两种元素最高价氧化物对应水化物和NaOH三者之间发生反应的离子方程式为:_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在两个恒容的密闭容器中进行下列两个可逆反应:
甲中,C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
乙中,CO(g)+H2O(g)  CO2(g)+H2(g)。现有下列状态:①混合气体平均相对分子质量不再改变;②恒温时,气体压强不再改变;③各气体组分浓度相等;
CO2(g)+H2(g)。现有下列状态:①混合气体平均相对分子质量不再改变;②恒温时,气体压强不再改变;③各气体组分浓度相等;
④反应体系中温度保持不变;⑤断裂氢氧键速率等于断裂氢氢键速率的2倍;⑥混合气体密度不变;⑦单位时间内,消耗水的质量与生成氢气的质量之比为9∶1;⑧同一时间内,水蒸气消耗的物质的量等于氢气消耗的物质的量。其中能表明甲、乙容器中反应都达到平衡状态的是( )
A.①②⑤ B.③④⑥ C.⑥⑦⑧ D.④⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为
( )
A.9 B.10 C.11 D.12
查看答案和解析>>
科目:高中化学 来源: 题型:
下图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )
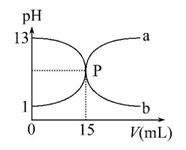
A.盐酸的物质的量浓度为1 mol·L-1
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
“纳米材料”是直径为几纳米至几十纳米的材料(1 nm=10-9m)。其研究成果已应用于医学、军事、化工等领域。如将“纳米材料”分散到水中,得到的分散系不可能具有的性质是( )
A.能全部通过半透膜 B.能全部通过滤纸
C.有丁达尔现象 D.有电泳现象
查看答案和解析>>
科目:高中化学 来源: 题型:
要检验溴乙烷中的溴原子,正确的实验方法是
A.加入氯水振荡,观察水层是否有红棕色出现
B.滴入AgNO3溶液,再加入稀硝酸,观察有无浅黄色沉淀生成
C.加入NaOH溶液共热,然后加入稀硝酸使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成
D.加入NaOH溶液共热,然后加入AgNO3溶液,观察有无浅黄色沉淀生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com