
| A. | 原子的最外层电子数都是7,次外层电子数都是8 | |
| B. | 单质的化学性质活泼,易得电子发生还原反应 | |
| C. | 单质都有颜色,且颜色逐渐变浅 | |
| D. | 都难溶于水,且不与水反应 |
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色; ②能与水在一定条件下反应生成C ③比例模型为: 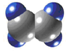 |
| B | ①由C、H两种元素组成; ②球棍模型为: 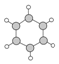 |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
| D | ①相对分子质量比C少2; ②能由C氧化而成; |
| E | ①由C、H、O三种元素组成; ②球棍模型为:  |
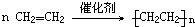 .
.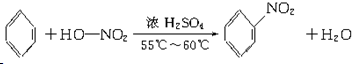 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠是一种强还原剂,可以将钛、铌等金属从其氯化物溶液中置换出来 | |
| B. | 铜能与氯化铁溶液反应,该反应可以应用于印刷电路板的制作 | |
| C. | 人们发现了118种元素,即共有118种核素 | |
| D. | H2和D2互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | c2 | c3 | c3 |
| 4 | C1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 金属质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
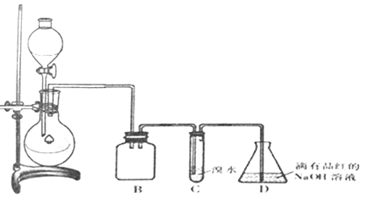
| 实验序号 | 实验操作 | 现象 | 可能的情况 |
| ① | 滴加少量淀粉-KI溶液,振荡 | III | |
| ② | 滴加少量溴水,振荡 | II | |
| ③ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3a+b-c | B. | c+3a-b | C. | a+b-c | D. | c+a-b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com