
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是()
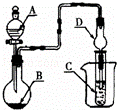
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
考点: 气体发生装置.
专题: 元素及其化合物.
分析: 根据装置图可知,该装置适用于固体和液体无需加热制取气体,制取的气体易溶于试管中的液体,据此对照各选项进行分析即可解答.
解答: 解:A.二氧化锰(MnO2)与浓盐酸混合加热可得到氯气,反应方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,而题目中的装置制取气体无需加热,所以无法制取氯气,C中盛品红溶液,则C中溶液无法褪色,故A错误;
MnCl2+Cl2↑+2H2O,而题目中的装置制取气体无需加热,所以无法制取氯气,C中盛品红溶液,则C中溶液无法褪色,故A错误;
B.贝壳的主要成分为碳酸钙,醋酸和碳酸钙反应CaCO3+2CH3COOH=Ca(CH3COO)2+H2O+CO2↑生成二氧化碳无需加热,二氧化碳和澄清石灰水反应CO2+Ca(OH)2═CaCO3↓+H2O生成不溶于水的碳酸钙所以试管中溶液变浑浊,故B正确;
C.实验室制备NH3,可用浓氨水和CaO固体反应,NH3•H2O+CaO═Ca(OH)2+NH3↑,浓氨水易挥发,CaO固体与水反应放出大量的热,导致温度升高,使得氨气在水中的溶解度进一步减少,以气体的形式逸出,制得氨气,可选择图中左图的制取装置,C中盛AlCl3溶液,氨气和水反应生成氨水,氨水和AlCl3溶液反应生成氢氧化铝沉淀,但氨水是弱碱,不能溶解氢氧化铝,C中不可能出现先产生白色沉淀后沉淀又溶解,故C错误;
D.亚硫酸是弱酸,硫酸是强酸,利用强酸制弱酸的原理,强酸硫酸和亚硫酸钠反应生成弱酸亚硫酸,亚硫酸分解生成二氧化硫和水,Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,所以能用图中左图的制取装置制备SO2,二氧化硫溶于水反应生成亚硫酸,能使C中盛石蕊试液变红,但不能漂白,所以不褪色,故D错误;
故选B.
点评: 本题考查了化学实验基本操作,掌握元素化合物的性质结合反应装置的特点分析是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:
在0.1mol•L﹣1 NH3•H2O溶液中存在如下电离平衡:NH3•H2O⇌NH4++OH﹣.对于该平衡,下列叙述中正确的是( )
|
| A. | 降低温度,溶液中c(NH4+)增大 |
|
| B. | 加入少量NaOH固体,平衡向逆反应方向移动,电离平衡常数减小 |
|
| C. | 加入少量0.1 mol•L﹣1 HCl溶液,溶液中c(OH﹣)增大 |
|
| D. | 加入水时,溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组通过测定大理石与硝酸反应过程中体系质量的变化,研究影响反应速率的因素.所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量均为25.0mL、大理石用量均为10.00g.
(1)请完成以下实验设计:
| 实验目的 | 实验编号 | T/K | 大理石规格 | c(HNO3) mol/L |
| (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究大理石规格(粗、细)对该反应速率的影响;) | ① | 298 | 粗颗粒 | 2.00 |
| ② | ||||
| ③ | ||||
| ④ |
(2)实验①中CO2质量随时间变化的关系见下图:
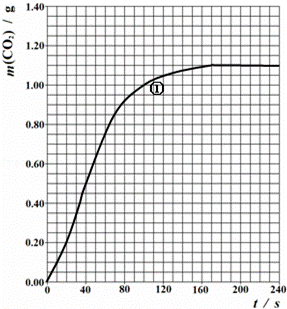
忽略溶液体积变化,计算实验①在40s﹣100s范围内HNO3的平均反应速率(保留2位小数): .
(3)请在答题纸上,画出实验②和③中CO2质量随时间变化关系的预期结果示意图.
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是一种试验某气体化学性质的实验装置,图中B为开关. 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶中盛有的溶液是()
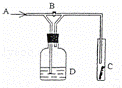
A. 浓H2SO4 B. 饱和Na2CO3溶液
C. 浓NaOH溶液 D. 饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
以下物质间的转化通过一步反应不能实现的是()
①HCl→Cl2→HClO→NaClO
②Na→Na2O2→Na2CO3→NaHCO3
③Al→NaAlO2→Al(OH)3→Al2O3
④Si→SiO2→H2SiO3→Na2SiO3
⑤S→SO3→H2SO4→Na2SO4
⑥Cu→CuCl2→Cu(OH)2.
A. ②③ B. ④⑤ C. ③④⑤⑥ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
如图中每一方格表示有关的一种反应物或生成物.A、C为无色气体.

(1)物质M可以是 或 ,C是 ,F是 .
(2)反应①的化学方程式 .
(3)反应②的离子方程式 .
(4)F→G的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列说法正确的是( )
|
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA |
|
| B. | 28g乙烯所含共用电子对数目为4NA |
|
| C. | 1 mol甲基的电子数目为9NA |
|
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com