
| A. | 白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 红热的铁丝与水接触表面形成蓝色保护层 | |
| D. | 在铁与稀H2SO4反应时,改用铁粉,可加快H2的产生 |
分析 属于原电池反应,说明符合原电池的构成条件,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应,以此解答.
解答 解:A.铁、锌和电解质溶液符合原电池构成条件,则形成原电池,锌易失电子作负极,铁作正极,正极金属被保护,所以发生原电池反应,故A正确;
B.铝在空气中,极易和氧气反应生成氧化物薄膜,该反应中没有两个活泼性不同的电极,不能构成原电池,所以发生的不是原电池反应,故B错误;
C.红热的铁丝和水直接反应生成黑色的四氧化三铁和氢气,不符合原电池构成条件,属于化学腐蚀,故C错误;
D.在铁与稀H2SO4反应时,改用铁粉,增大了固体的表面积,与硫酸的接触面积增大,所以可加快H2的产生,与电化学无关,故D错误.
故选A.
点评 本题考查了化学腐蚀和电化学腐蚀的判断,侧重于学生的分析能力的考查,根据原电池构成条件来分析解答即可,难度不大.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:多选题
数据编号 | 加入NaOH溶液的体积/mL | 溶液的pH | ||
| C(HX) | c(HY) | |||
| ① | 0 | 4 | 1 | |
| ② | a | 7 | ||
| ③ | 20.00 | x | y | |
| A. | 由表中数据可估算出25℃时Ka(HX)≈10-8 | |
| B. | 在相同温度下,物质的量浓度相同的两种酸溶液的导电能力为HX<HY | |
| C. | 编号②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+) | |
| D. | 编号③反应的溶液中:c(X-)>c(Y-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化镭[Ra(OH2)]比氢氧化钙的碱性强 | |
| B. | 砹(At)的单质颜色为黑色 | |
| C. | 铍(Be)的原子失电子能力比镁弱 | |
| D. | 硒(Se)化氢比硫化氢稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
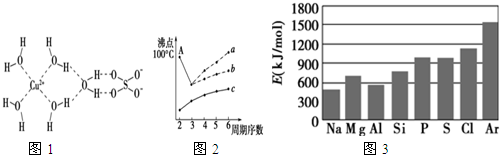
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
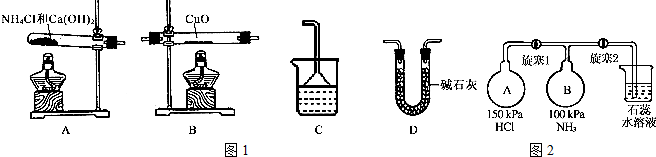
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
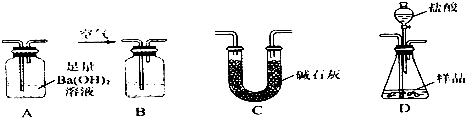
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(CN-)>c(OH-)>c(H+) | B. | c(HCN)+(CN-)=0.04 mol•L-1 | ||
| C. | c(Na+)+c (OH-)=c(CN-)+c(H+) | D. | c(CN-)>c(HCN) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO${\;}_{4}^{2-}$、OH- |
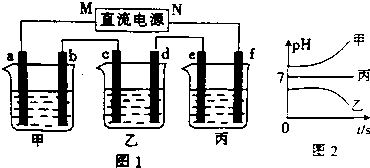
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com