
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 |
|
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物化学式为 。
(3)C常用作净水剂,用离子方程式表示其净水原理 。
(4)在A溶液中加入少量澄清石灰水,其离子方程式为 。
(5)向20 mL 2 mol·L-1C溶液中加入30 mL E溶液,充分反应后得到0.78 g沉淀,则E溶液的物质的量浓度可能是 mol·L-1。
【解析】由①知D中含Cu2+,由④知D中含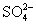 ,故D为CuSO4;由②知C中含Al3+,由③知C中含K+,由④知C中还含
,故D为CuSO4;由②知C中含Al3+,由③知C中含K+,由④知C中还含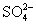 ,故C为KAl(SO4)2;由②知E中含OH-,结合③可判断出E为NaOH;由④知A中含
,故C为KAl(SO4)2;由②知E中含OH-,结合③可判断出E为NaOH;由④知A中含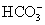 ,结合③可判断A为NaHCO3;B中含K+,由④知B中不含
,结合③可判断A为NaHCO3;B中含K+,由④知B中不含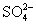 ,结合⑤可判断B只能为KNO3。
,结合⑤可判断B只能为KNO3。
(2)等物质的量的NaHCO3和NaOH在溶液中恰好反应:NaHCO3+NaOH====Na2CO3+H2O得Na2CO3溶液,将Na2CO3溶液蒸干得溶质Na2CO3。
(3)KAl(SO4)2在水中电离出Al3+,Al3+水解生成的Al(OH)3胶体能吸附水中的悬浮杂质形成沉淀,所以KAl(SO4)2可作净水剂。
(4)根据离子方程式书写的“以少定多”原则,可写出该反应的离子方程式。
(5)若NaOH不足,n(NaOH)=3n[Al(OH)3]=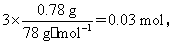
c(NaOH)=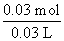 =1 mol·L-1;若NaOH过量,完全沉淀Al3+消耗NaOH的物质的量为3×2 mol·L-1×0.02 L=0.12 mol,溶解Al(OH)3沉淀消耗NaOH的物质的量为0.03 mol,故c(NaOH)=
=1 mol·L-1;若NaOH过量,完全沉淀Al3+消耗NaOH的物质的量为3×2 mol·L-1×0.02 L=0.12 mol,溶解Al(OH)3沉淀消耗NaOH的物质的量为0.03 mol,故c(NaOH)=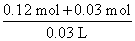 =5 mol·L-1。
=5 mol·L-1。
答案:(1)KNO3 CuSO4 (2)Na2CO3
(3)Al3++3H2O Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
(4)2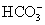 +Ca2++2OH-====CaCO3↓+2H2O+
+Ca2++2OH-====CaCO3↓+2H2O+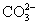 (5)1或5
(5)1或5


科目:高中化学 来源: 题型:
已知元素X、Y的原子最外层分别有n个和(m-5)个电子,次外层分别有(n+2)个和m个电子,据此推断:
(1)元素X和Y分别是________和________(填元素符号);其电子排布式分别为_________和_________;其价电子的电子排布图分别为_________和_________。
(2)这两种元素最高价氧化物对应水化物和NaOH三者之间发生反应的离子方程式为:_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
“纳米材料”是直径为几纳米至几十纳米的材料(1 nm=10-9m)。其研究成果已应用于医学、军事、化工等领域。如将“纳米材料”分散到水中,得到的分散系不可能具有的性质是( )
A.能全部通过半透膜 B.能全部通过滤纸
C.有丁达尔现象 D.有电泳现象
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②盐都是强电解质
③0.5 mol·L-1的所有一元酸中氢离子浓度都是0.5 mol·L-1
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子
⑥熔融的电解质都能导电
A.①③⑤⑥ B.②④⑤⑥
C.只有⑤ D.只有⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的
是( )
A.0.1 mol·L-1NaOH溶液:K+、Na+、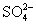 、
、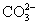
B.0.1 mol·L-1Na2CO3溶液:K+、Ba2+、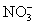 、Cl-
、Cl-
C.0.1 mol·L-1FeCl3溶液:K+、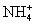 、I-、SCN-
、I-、SCN-
D.c(H+)/c(OH-)= 1×1014的溶液:Ca2+、Na+、ClO-、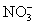
查看答案和解析>>
科目:高中化学 来源: 题型:
将体积均为5 mL的甲、乙、丙三种液体依次沿试管壁缓缓滴入试管中(严禁振荡),出现如图所示的实验现象,则甲、乙、丙的组合可能是
| 甲 | 乙 | 丙 | |
| A | 1,2—二溴乙烷 | 水 | 苯 |
| B | 溴苯 | 液溴 | 乙醇 |
| C | 水 | 大豆油 | 溴水 |
| D | 乙醇 | 乙酸 | 乙酸乙酯 |
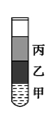
查看答案和解析>>
科目:高中化学 来源: 题型:
要检验溴乙烷中的溴原子,正确的实验方法是
A.加入氯水振荡,观察水层是否有红棕色出现
B.滴入AgNO3溶液,再加入稀硝酸,观察有无浅黄色沉淀生成
C.加入NaOH溶液共热,然后加入稀硝酸使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成
D.加入NaOH溶液共热,然后加入AgNO3溶液,观察有无浅黄色沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表述不正确的是
A.福岛核电站泄露的放射性物质131I与127I互为同位素,化学性质几乎相同
B.电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述
C.除去SO2中混有的少量HCl,使气体通过盛有饱和NaHSO3溶液的洗气瓶
D.为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:Fe2+能被稀硝酸氧化,反应方程式为:
3Fe(NO3)2 + 4HNO3(稀) → 3 Fe(NO3)3 + NO↑+ 2H2O
现将一定量的铁和铜的混合物分为等质量的4份,分别加入等浓度不同体积的稀硝酸(假设反应中稀硝酸的还原产物只有NO),产生气体的体积与剩余固体的质量如下表:
| 硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
| 放出气体的体积(mL) | 2240 | 4480 | 6720 |
(1)放出4480 mL气体时,消耗金属的质量为_______g
(2)稀硝酸的浓度为_______ mol·L-1
(3)计算原混合物中铁和铜的物质的量比为
(4)加入400 mL稀硝酸,反应完全后,溶液中硝酸根离子的物质的量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com