
化学与生活密切相关,下列有关说法错误的是( )
A.用灼烧的方法可以区分蚕丝和人造纤维
B.食用油反复加热不会产生稠环芳香烃等有害物质
C.加热能杀死流感病毒是因为蛋白质受热变性
D.医用消毒酒精中乙醇的浓度为75%
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙的化学式:CaClO2 | |
| B. | 作为相对原子质量标准的碳原子可表示为:126C | |
| C. | 钠原子的结构示意图: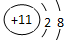 | |
| D. | 硫酸的电离方程式:H2SO4═H++SO42- |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
常温时0.05mol/L的Ba(OH)2溶液,pH为 ( )
A.12.7 B.12.0 C.13.0 D.13.7
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.加入铝粉能产生氢气的溶液:Mg2+、K+、Br-、HCO3-
B.滴入石蕊显红色的溶液:Na+、K+、S2-、NO3-
C.pH = 14的溶液中:Na+、AlO2-、SO42-、Cl-
D.滴入KSCN溶液显红色的溶液中:Ca2+、H+、I-、Cl-
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A. 物质A由Z与Y两种元素组成,则0.5 mol物质A中含有的离子数约为9.03×1023
B. 元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大
C. 元素Z、R的氧化物的水化物之间相互反应生成的盐溶液呈中性或碱性
D. 元素Y、R分别与元素X形成的化合物的沸点:XmY < XmR
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:填空题
查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4?(绿色)、Cr2O72?(橙红色)、CrO42?(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)铬(24Cr)属于_______________(选填编号)。
a.主族元素 b.副族元素 c.Ⅷ族元素 d.过渡元素
(2)铬单质是银白色有金属光泽的固体,有较高的熔点,是最硬的金属;与Ni等添加到Fe中可制成不锈钢。比较硬度:纯铁_________不锈钢;熔点:纯铁__________不锈钢(填“>”“<”或“=”)。
(3)Cr(OH)3与Al(OH)3的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是___________________。
(4)CrO42?和Cr2O72?在溶液中可相互转化。室温下,初始浓度为1.0 mol·L?1的Na2CrO4溶液中c(Cr2O72?)随c(H+)的变化如图所示。
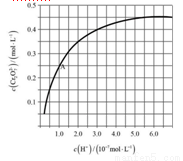
①用离子方程式表示Na2CrO4溶液中的转化反应____________________。
②由图可知,溶液酸性增大,CrO42?的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42?的平衡转化率减小,则该反应的ΔH__________0(填“>”“<”或“=”)。
(5)+6价铬的化合物毒性较大,但其化合物用途广泛。如:“酒精检测仪”可检查司机是否酒驾,其反应原理为:m C2H5OH+ n X + p H2SO4═ g Cr2(SO4)3 + w CO2↑+ 9H2O,其中X的化学式最有可能为__________。常用NaHSO3将酸性废液中的Cr2O72?还原成Cr3+,该反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
材料、能源、信息、环境与化学关系密切,下列说法不正确的是
A.我们使用合金是因为它比纯金属具有更优良的机械性能
B.钢化玻璃、有机玻璃、石英玻璃均属于硅酸盐材料
C.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水
D.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业合成氨时选择500℃ | |
| B. | 配制FeCl3溶液时加入少量的盐酸 | |
| C. | 在Na2CO3溶液中,由水电离出的c(OH-)>1×10-7mol/L | |
| D. | AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com