
| A. | 原电池是把电能转化为化学能的装置 | |
| B. | 原电池两极均发生氧化还原反应 | |
| C. | 原电池中的阳离子向正极移动 | |
| D. | 原电池中电子流出的一极是正极,发生氧化反应 |
分析 A.原电池是将化学能转化为电能的装置;
B.原电池一个电极发生氧化反应、一个电极发生还原反应;
C.原电池放电时,阳离子向正极移动、阴离子向负极移动;
D.原电池中电子流出的电极是负极,发生氧化反应.
解答 解:A.原电池是将化学能转化为电能的装置,电解池是将电能转化为化学能的装置,故A错误;
B.原电池一个电极失电子发生氧化反应、一个电极得电子发生还原反应,故B错误;
C.原电池放电时,负极上失电子、正极上得电子,所以负极附近聚集大量阳离子、正极附近聚集大量电子,则阳离子向正极移动、阴离子向负极移动,故C正确;
D.原电池中电子流出的电极是负极,发生氧化反应,电子流入的电极是正极,发生还原反应,故D错误;
故选C.
点评 本题考查原电池和电解池原理,明确各个电极上发生的反应、电子流向、离子流向是解本题关键,易错选项是C.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢的五种不同粒子 | B. | 五种氢元素 | ||
| C. | 氢的五种同素异形体 | D. | 氢元素的五种同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
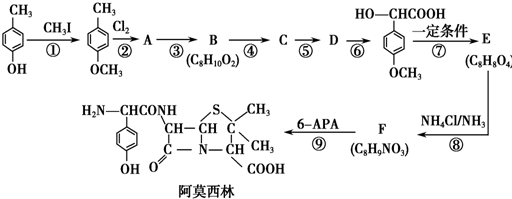
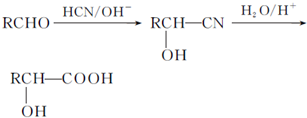

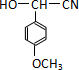 .
.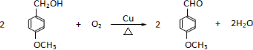 .
.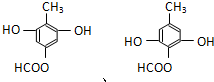 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
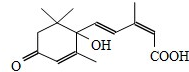 节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的是( )
节日期间对大量盆栽鲜花施用S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列说法正确的是( )| A. | 1mol该分子可与1molNa发生反应产生H2 | |
| B. | 分子中含有两种官能团 | |
| C. | 可发生加成反应和取代反应 | |
| D. | 该分子不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是
25℃下,向20mL 0.1mol•L-1H2A溶液中滴加0.1mol•L-1NaOH溶液,有关粒子物质的量的变化如图所示.下列有关说法正确的是| A. | H2A属于强酸 | |
| B. | $\frac{C({HA}^{-})}{C{(H}_{2}A)}$随着V[NaOH(aq)]的增大而增大 | |
| C. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(HA-)+c(A2-)+c(H2A)=0.1mol•L-1 | |
| D. | V[NaOH(aq)]=20mL时,溶液中存在关系:c(Na+)>c(HA-)>c(H+)>C(A2-)>C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Fe | H2O(g) | Fe3O4 | H2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
| Fe | H2O(g) | Fe3O4 | H2 | |
| 起始/mol | 3.0 | 4.0 | 0 | 0 |
| 平衡/mol | m | n | p | q |
| Fe | H2O(g) | Fe3O4 | H2 | |
| A/mol | 3.0 | 4.0 | 0 | 0 |
| B/mol | 0 | 0 | 1.0 | 4.0 |
| C/mol | m | n | p | q |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | FeO、FeS、CuO、CuS、稀硫酸 | |
| B. | 苯、四氯化碳、无水乙醇、己烯 溴水 | |
| C. | 甲酸、乙酸、乙醛、乙醇 新制氢氧化铜悬浊液 | |
| D. | 苯酚钠溶液、甲苯、乙酸乙酯、乙酸 饱和碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
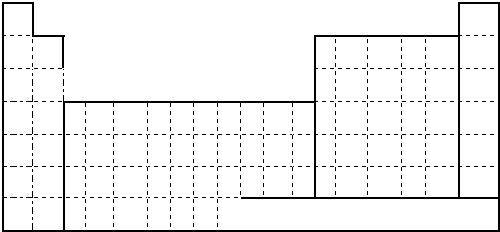
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com