
 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源:不详 题型:单选题
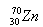 高能原子轰击
高能原子轰击  的靶子,使锌核与铅核熔合而得,每生成一个112号元素的原子(
的靶子,使锌核与铅核熔合而得,每生成一个112号元素的原子( 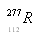 )的同时向外释放出一个中子。下列说法错误的是
)的同时向外释放出一个中子。下列说法错误的是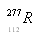 原子中子数为165 D.112号元素为放射性元素
原子中子数为165 D.112号元素为放射性元素查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
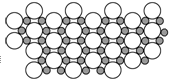
| A.MgB | B.MgB2 | C.Mg2B | D.MgB6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.晶体中分子间作用力越大,分子越稳定 |
| B.乙醇的沸点比甲醚(CH3—O—CH3)高,主要原因是乙醇分子间能形成氢键 |
| C.红宝石、蓝宝石和金刚石都是由碳元素组成的宝石 |
| D.非金属的最高价含氧酸都具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.元素的最高正化合价在数值上一定等于它所在的族序数 |
| B.同周期主族元素的原子半径越小,越难失去电子 |
| C.元素的非金属性越强,它的气态氢化物的沸点越高 |
| D.酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ①W的原子序数为29,其余的均为短周期主族元素;
①W的原子序数为29,其余的均为短周期主族元素;| I1 | I2 | I3 | I4 | I5[] | ...... |
| 578 | 1817 | 2745 | 11575 | 14380 | ...... |







 (1)
(1)





 W元素位于周期表的 区,Z2+ 的核外电子排布式是 。
W元素位于周期表的 区,Z2+ 的核外电子排布式是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
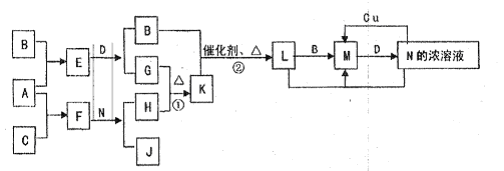
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com