
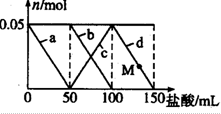
 向含Na2CO3,NaAlO2的混合溶液中加入150mL1mol?L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )
向含Na2CO3,NaAlO2的混合溶液中加入150mL1mol?L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )| A、a曲线表示的离子方程式为:AlO2-+H++H2O═Al(OH)2↓ |
| B、b和c曲线表示的离子反应是相同的 |
| C、原混合溶液中CO32-与Al2-的物质的量之比为1:1 |
| D、M点时,溶液中沉淀的质量为3.9g |


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(a) | B、(b) |
| C、(a)(c) | D、(a)(d) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加水溶解,观察溶液温度变化 |
| B、取相同质量敞口放置,过一段时间在称量,比较质量变化 |
| C、取相同量,加入到氯化钡溶液中,观察是否有沉淀产生 |
| D、取相同量于试管中,加入铜片,加热观察,是否有刺激性气味的气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| 过量稀硫酸 |
| ②操作a |
| ③双氧水 |
| H+ |
| ④氨水 |
| 操作b |
| ⑤灼烧 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑥ | B、①③④⑥ |
| C、③④⑤⑥ | D、全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com