
【题目】核磁共振谱表明普鲁卡因 J(C13H20N2O2)中苯环上只有两类氢,它的合成路线如下:

请回答下列问题:
(1)物质 C 的名称是________________;F→G 反应类型是___________________;
(2)铁粉需要活化的理由是______________________________________________;
(3)已知普鲁卡因的阳离子(代号:BH+)的电离常数 Ka= 1×10-9。请计算在 pH=7 时,盐酸普普卡因溶液里的 B 和 BH+的浓度比________;
(4)写出 D→E 的化学方程式________________________________________________;
(5)K 是比 D 多一个碳原子的同系物,写出符合下列条件的 K 的所有同分异构体的结构简式___________;
①属于芳香族化合物
②能与碳酸氢钠溶液反应
③H-NMR 谱显示有 5 种氢原子
(6)参照上述合成路线和信息,用物质 C、二甲苯、HOCH2CH2N(C2H5)2 为原料(其他无机试剂任选)合成盐酸普鲁卡因。(已知:二甲苯和水易形成共沸混合物)_________________________。
【答案】对硝基苯甲酸 加成反应 铁粉形成Fe2O3阻碍反应进行 1:100 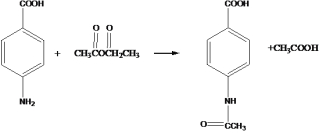
![]()
![]()
![]()
【解析】
核磁共振谱表明普鲁卡因 J(C13H20N2O2)中苯环上只有两类氢,说明苯环上的取代基在对位上,由此可推:A为甲苯,B为对硝基甲苯,C为对硝基苯甲酸,D为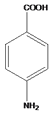 ,
, 与乙酸酐反应生成E为
与乙酸酐反应生成E为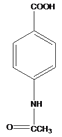 ;乙烯与次氯酸反应生成G为HOCH2CH2Cl,
;乙烯与次氯酸反应生成G为HOCH2CH2Cl, 与HOCH2CH2Cl在酸性条件下反应生成H为
与HOCH2CH2Cl在酸性条件下反应生成H为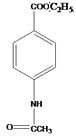 ,
, 与(CH3CH2)2NH反应生成I为
与(CH3CH2)2NH反应生成I为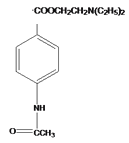 ,
, 反应生成J为
反应生成J为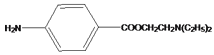 ,据此分析。
,据此分析。
核磁共振谱表明普鲁卡因 J(C13H20N2O2)中苯环上只有两类氢,说明苯环上的取代基在对位上,由此可推:A为甲苯,B为对硝基甲苯,C为对硝基苯甲酸,D为 ,
, 与乙酸酐反应生成E为
与乙酸酐反应生成E为 ;乙烯与次氯酸反应生成G为HOCH2CH2Cl,
;乙烯与次氯酸反应生成G为HOCH2CH2Cl, 与HOCH2CH2Cl在酸性条件下反应生成H为
与HOCH2CH2Cl在酸性条件下反应生成H为 ,
, 与(CH3CH2)2NH反应生成I为
与(CH3CH2)2NH反应生成I为 ,
, 反应生成J为
反应生成J为 。
。
(1)物质 C 的名称是对硝基苯甲酸;F→G是乙烯与次氯酸发生加成反应生成HOCH2CH2Cl,反应类型是加成反应;
(2)铁粉需要活化的理由是铁粉形成Fe2O3阻碍反应进行;
(3) pH=7 时,c(H+)=10-7mol/L,已知普鲁卡因的阳离子(代号:BH+)的电离常数 Ka= 1×10-9,Ka=![]() =1×10-9,故盐酸普普卡因溶液里的 B 和 BH+的浓度比1:100;
=1×10-9,故盐酸普普卡因溶液里的 B 和 BH+的浓度比1:100;
(4) D→E 为 与乙酸酐反应生成
与乙酸酐反应生成 ;反应的化学方程式为
;反应的化学方程式为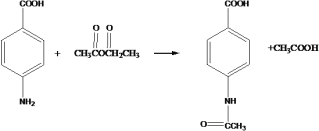 ;
;
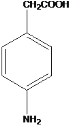
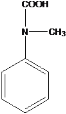
(5)K 是比 D 多一个碳原子的同系物,符合:①属于芳香族化合物,②能与碳酸氢钠溶液反应,则含有酚羟基或羧基;③H-NMR 谱显示有 5 种氢原子,则高度对称,符合条件的同分异构体有 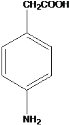
![]()
![]()
![]()
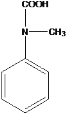 ;
;
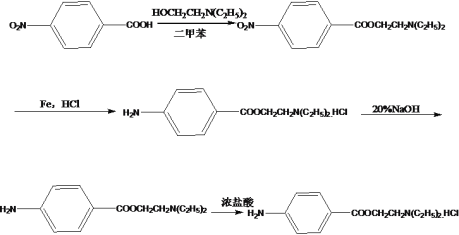
(6)参照上述合成路线和信息,用物质 C(对硝基苯甲酸)、二甲苯、HOCH2CH2N(C2H5)2 为原料合成盐酸普鲁卡因。合成路线如下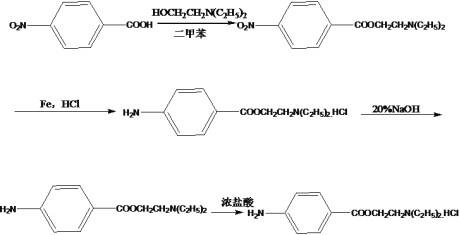 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知:p[c(HX)/c(X-)]=-lg[c(HX)/c(X-)]。室温下,向0. 10 mol/LHX溶液中滴加0.10 mol/L NaOH溶液,溶液pH随p[c(HX)/c(X-)]变化关系如图。下列说法不正确的是
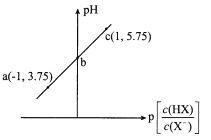
A. 溶液中水的电离程度:a<b<cB. 图中b点坐标为(0,4.75)
C. c点溶液中:c(Na+) =l0c(HX)D. 室温下HX的电离常数为10-4. 75
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式__________。
(2)已知在25℃、101kPa下,1 g乙醇在氧气中充分燃烧生成二氧化碳和液态水释放出29.7 kJ的热量,试写出乙醇燃烧热的热化学方程式_______________。
(3)标准状况下,4.48L H2在足量O2中完全燃烧放出热量Q kJ,写出H2燃烧的热化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下浓度均为0.1 mol·L-1的下列溶液的pH如表:
溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
pH | 8.1 | 11.6 | 9.7 | 8.4 |
下列有关说法正确的是( )
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B. 等体积、等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N前<N后
C. 若将少量CO2通入NaClO溶液至溶液中,离子方程式为:ClO-+CO2+H2O=HClO+CO32-
D. 向Na2CO3溶液中通入少量的HF气体,化学方程式为Na2CO3+2HF = CO2+H2O+2NaF
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有机物的描述正确的是
A. 组成为C6H14的烷烃中仅能由1种单炔烃加氢而制得的结构有2种
B. 立方烷( ![]() )燃烧的现象与乙烷燃烧的现象相同
)燃烧的现象与乙烷燃烧的现象相同
C. ![]() 分子中所有原子不可能处于同一平面
分子中所有原子不可能处于同一平面
D. 用碳酸钠溶液不能一次性鉴别乙酸、苯和乙醇三种无色液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将等浓度等体积的弱酸HA和HB与NaHCO3反应放出CO2的体积与时间的关系如图所示,则以下说法错误的是:( )

A. 酸性:HA<HB
B. pH均为4的HA和HB溶液中和等量NaOH时,所需HA溶液体积小
C. pH均为9的NaA溶液和NaB溶液相比,NaA溶液中水的电离程度大
D. 浓度均为0.1mol/L的NaA溶液和NaB溶液相比,NaA溶液中水的电离程度大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是

①m+n>p ②x点表示的正反应速率大于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若升高温度,该反应的平衡常数增大
A. ①②⑤ B. 只有②④ C. 只有①③ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积固定的密闭容器中,可逆反应H2(g)+I2(g) ![]() 2HI(g)达到平衡时的标志是( )
2HI(g)达到平衡时的标志是( )
A.混合气体密度恒定不变B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等D.I2在混合气体中体积分数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com