


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:
| A、1L溶液中含有0.4NA个钾离子 |
| B、1L溶液中含有K+离子和SO42-离子总数为0.9NA |
| C、2L溶液中钾离子的浓度为1.2mol/L |
| D、2L溶液中含有0.3NA个SO42-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、① | B、②③ | C、①③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 3 |
| 2 |
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤 | 现象 |
| ⅰ.向盛有30mL 0.2mol?L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
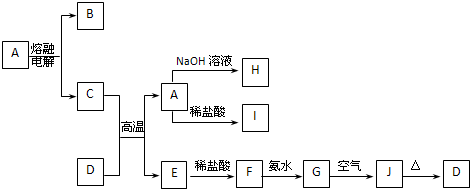
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com