

分析 A在标准状况下的密度为1.25g•L-1,A的摩尔质量为1.25g/L×22.4L/mol=28g/mol,由合成流程可知,B、D是生活中常见的两种有机物,B为醇,则A为CH2=CH2,B为CH3CH2OH,C为CH3CHO,D为CH3COOH,B与D发生酯化反应生成乙酸乙酯,以此来解答.
解答 解:(1)由上述分析可知,A为CH2=CH2,C为乙醛,官能团名称为醛基,故答案为:CH2=CH2;醛基;
(2)第③步反应生成D的同时还生成HBr,该步反应的化学方程式为CH3CHO+Br2+H2O→CH3COOH+2HBr,
故答案为:CH3CHO+Br2+H2O→CH3COOH+2HBr;
(3)a.石油中含大分子烃,裂解是工业上大量获得烃A的主要方法,故a正确;
b.水中羟基H比醇中羟基H活泼,则相同条件下,有机物B与钠反应不如水与钠反应剧烈,故b错误;
c.用浓NaOH溶液与乙酸乙酯发生水解反应,不能除杂,应选饱和碳酸钠溶液除杂,故c错误;
d.有机物A与D在一定条件下生成乙酸乙酯的反应,碳碳双键转化为单键,则属于加成反应,故d正确;
故答案为:ad.
点评 本题考查有机物的推断,为高频考点,把握B可发生连续氧化反应、官能团的变化为解答的关键,侧重分析与推断能力的考查,注意A为乙烯,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,c(H+)亦增大 | |
| C. | 再加入10 mL pH=11 NaOH溶液,混合液pH=7 | |
| D. | 溶液中$\frac{{c[CH}_{3}{COO}^{-}]}{{c[CH}_{3}COOH]{c[OH}^{-}]}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制FeCl2溶液时,加入铁粉的原因:Fe+Fe3+═2Fe2+ | |
| B. | 二氧化锰和浓盐酸反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl2↑+2H2O | |
| C. | “水玻璃”长期暴露在空气中会变质:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| D. | 向硫酸氢钠溶液中滴加氢氧化钡溶液至中性:H++SO42++Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 相同温度下,0.1mol•L-1盐溶液的pH值:Na2CO3>NaHCO3 | |
| C. | 等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应放出气体的量:Na2CO3<NaHCO3 | |
| D. | 相同温度下,0.1mol•L-1盐溶液分别与0.1mol•L-1HCl反应的剧烈程度:Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
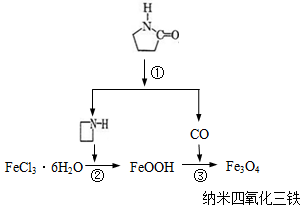 纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )
纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗.其制备过程如图所示、下列叙述不合理的是( )| A. | 在反应②中,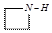 的作用可能是促进氯化铁水解 的作用可能是促进氯化铁水解 | |
| B. | 反应③的化学方程式是:6FeOOH+CO═2Fe3O4+3H2O+CO2 | |
| C. | 直接加热FeCl3溶液也可以得到四氧化三铁 | |
| D. | 纳米四氧化三铁形成的分散剂,有可能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | ||
| Y | Z |
| A. | Z元素的最高价氧化物水化物的酸性强于Y | |
| B. | 由W元素形成的分子W2中存在三个共价键 | |
| C. | 四种元素常见的氢化物:YH4、WH3、H2X、HZ中,YH4最稳定 | |
| D. | 氢化物WH3与HZ反应生成的离子化合物中存在10e-、18 e-两种微粒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com