
【题目】X、Y、Z、P、Q、W、R、T是元素周期表短周期中的常见主族元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
X | 其一种同位素,可被用作相对原子质量的标准 |
Y | 其最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应 |
P | 是短周期中(除稀有气体外)原子半径最大的元素 |
Q | 存在质量数为25,中子数为13的核素 |
W | 位于周期表第13列 |
R | 与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质会出现钝化现象 |
(1)R在元素周期表中的位置为 ;将Q、W、Z、Y的简单离子的半径从大到小排序___________________________________________(用离子符号表示)
(2)T的单质易溶于XT4中,理由是:____________________________________________。
(3)根据下表中信息,判断下列化合物固态的晶体类型(填“离子晶体”… 等):
化合物 | X3Y4 | R2T2 |
晶体类型 | ||
熔点/℃ | >3600 | -76 |
(4)任意写出一个由Y、Z元素分别与氢元素形成的10电子粒子间相互反应的离子方程式:___________。
(5)在25℃、101 kPa下,已知13.5 g的W固体单质在Z2气体中完全燃烧后恢复至原状态,放热419 kJ,写出表示W单质燃烧热的热化学方程式 。
(6)化合物P2R溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构相似的物质P2R2,其溶液显黄色,则P2R2的电子式为 ,用化学方程式表示P2R溶液在空气中的变质过程 。
【答案】(1)第三周期,第VIA族 N3-> O2-> Mg2+>Al3+
(2)Cl2和CCl4均为非极性分子,根据相似相溶原理,Cl2易溶于CCl4中
(3)原子晶体 分子晶体
(4)NH4++ OH- = NH3↑ + H2O(或者写为NH3H2O亦可) 或NH3+ H3O+= NH4++ H2O
(5)Al(s)+3/4O2(g)= 1/2Al2O3(s)△H=" -" 838 kJ/mol;
(6)![]() 4Na2S+O2+2H2O=4NaOH+2Na2S2
4Na2S+O2+2H2O=4NaOH+2Na2S2
【解析】试题分析:X的一种同位素,可被用作相对原子质量的标准,则X为C元素,Y的最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应,则Y为N元素,短周期中(除稀有气体外)原子半径最大的元素是Na,则P为Na元素,质量数为25,中子数为13的核素的质子数为25-13=12,则Q为Mg元素,位于周期表第13列,且原子序数大于12的元素是13号元素Al,W为Al元素,R与Z同族,且最高价氧化物对应水化物的浓溶液常温下与铝单质会出现钝化现象,则Z为O元素,R为S元素,T为Cl元素。
(1)根据上述推断,R为16号元素S元素,S在元素周期表中的位置为第三周期,第VIA族;Q、W、Z、Y的简单离子分别为Mg2+、Al3+、O2-、N3-,它们的核外电子排布相同,质子数越多,离子半径越小,则离子半径从大到小排序为N3-> O2-> Mg2+>Al3+。
(2)根据上述推断,T的单质是氯气,XT4是CCl4,Cl2和CCl4均为非极性分子,根据相似相溶原理,Cl2易溶于CCl4中。
(3)熔点较高的晶体是原子晶体,而常温常压下是气体或液体的晶体是分子晶体。
(4)Y、Z元素分别与氢元素形成的10电子粒子分别是NH4+、OH-,两者相互反应的离子方程式为NH4++ OH- ="=" NH3↑ + H2O。
(5)根据上述分析,W为Al,在25℃、101 kPa下,13.5 g Al的物质的量为0.5mol,0.5molAl在O2气体中完全燃烧后恢复至原状态,放热419 kJ,则1molAl在氧气中完全燃烧后恢复至原状态,放热838kJ,Al的燃烧热的热化学方程式为Al(s)+3/4O2(g)= 1/2Al2O3(s)△H=" -" 838 kJ/mol。
(6)化合物P2R为Na2S,Na2S溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构相似的物质Na2S2,则Na2S2的电子式为![]() ,Na2S溶液在空气中变质的化学方程式为4Na2S+O2+2H2O=4NaOH+2Na2S2。
,Na2S溶液在空气中变质的化学方程式为4Na2S+O2+2H2O=4NaOH+2Na2S2。


科目:高中化学 来源: 题型:
【题目】I.SO2是硫酸工业尾气的主要成分。实验室中,拟用下图所示流程,测定标准状况下,体积为VL的硫酸工业尾气中SO2的含量:
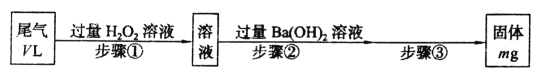
(1)步骤①中加入H2O2溶液时发生反应的离子方程式为______________________。
(2)一定温度下,BaSO4的沉淀溶解平衡曲线如图所示。步骤②逐滴加入Ba(OH)2溶液的过程中,BaSO4的溶度积常数__________(填“增大”、“减小”或“不变”),溶液中SO42-浓度的变化情况为____________(填序号)。
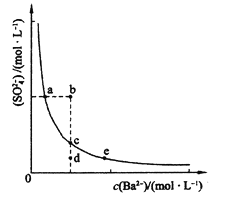
①d→c→e ②b→c→d
③a→c→e ④d→c→a
(3)该V L尾气中SO2的体积分数为________(用含有V、m的代数式表示)。
II.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中准确配制250 mL烧碱溶液
B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂
C.在天平上准确称取烧碱样品m g,在烧杯中用蒸馏水溶解
D.将浓度为c mol·L-1的标准硫酸装入酸式滴定管,调整液面记下开始读数V1
E.在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数V2
就此实验完成下列填空:
①正确的操作步骤的顺序是(用编号字母填写):________________。
②取碱液过程中眼睛应注视_______________________。
③滴定操作中,锥形瓶残留少量蒸馏水,则测得的结果__________(填“偏大”、“偏小”或“不变”,下同);达到滴定终点时,尖嘴处尚有一滴液滴未滴下,则测得的结果____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,某有机物一定条件下,与碳酸氢钠、钠均能产生气体,且生成的气体体积比(同温同压)为1:1,则此有机物可能是( )
A.HOOCCOOH B.HOCH2CH2CH2COOH
C.HOCH2CH2OH D.CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某补血剂样品【主要成分是硫酸亚铁晶体(FeSO4·7H2O)】中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用标准酸性KMnO4溶液滴定以测定铁元素的含量
⑴ 写出滴定反应的离子方程式 。
⑵ 下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号)。

⑶ 实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 (填仪器名称)
方案二:将FeSO4转化为Fe2O3,测定质量变化操作流程如下:

⑷ 步骤②中除用H2O2外还可以使用的物质是 。
⑸ 步骤②是否可以省略 ,理由是 。
⑹ 步骤④中一系列操作依次是:过滤、 、 、冷却、称量。
⑺ 假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法中正确的是( )。
A.二氧化锰能加快所有化学反应的速率
B.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
C.100 mL 2 mol·L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率变小
D.对于任何反应,增大压强都可加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol某烃能与2mol HCl加成,加成后产物上的氢原子最多能被8mol Cl2取代,则该烃可能为
A.乙炔 B.乙烯
C.苯 D.1,3-丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出).其中,I是由第三周期元素组成的单质中熔点最高的金属,K是一种红棕色气体.

请填写下列空白:
(1)在周期表中,组成单质G的元素位于第 周期 族.
(2)在反应⑦中氧化剂与还原剂的物质的量之比为 .
(3)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是 .(填写序号)
(4)反应④的离子方程式是: .
(5)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O.该反应的化学方程式是: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com