
| A. | 热空气能吹出溴是利用溴易挥发的性质 | |
| B. | SO2吸收溴的反应方程式:SO2+2H2O+Br2→H2SO4+2HBr | |
| C. | 流程中循环利用的物质有SO2、Br2、Cl2等多种 | |
| D. | 没有采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能 |
分析 用空气从含Br2的海水将Br2吹出得到含Br2的空气,用二氧化硫吸收,得到吸收液,发生的反应为SO2+2H2O+Br2=H2SO4+2HBr,然后将吸收液氯化,发生的反应为2HBr+Cl2=Br2+2HCl,得到溴水混合物,然后采用蒸馏的方法得到液溴,据此分析解答.
解答 解:用空气从含Br2的海水将Br2吹出得到含Br2的空气,用二氧化硫吸收,得到吸收液,发生的反应为SO2+2H2O+Br2=H2SO4+2HBr,然后将吸收液氯化,发生的反应为2HBr+Cl2=Br2+2HCl,得到溴水混合物,然后采用蒸馏的方法得到液溴,
A.二氧化硫具有还原性,溴具有强氧化性,二者能发生氧化还原反应,反应方程式为SO2+2H2O+Br2=H2SO4+2HBr,故A正确;
B.溴易挥发,所以热空气能吹出溴是利用溴易挥发的性质,故B正确;
C.该流程图中能循环利用的物质有二氧化硫和氯气,没有溴,故C错误;
D.海水中溴的含量很低,如果直接采用直接蒸馏含溴海水得到单质溴浪费能源,将溴还原的目的是富集溴,达到节能的目的,故D正确;
故选C.
点评 本题考查海水资源的综合利用,题目难度中等,侧重考查分析、判断能力,根据流程明确实验原理为解答关键,注意掌握化学实验基本操作方法,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 由上述热化学方程式可知d>c | |
| B. | H2的燃烧热为d kJ/mol | |
| C. | CH3OH(g)═CO(g)+2H2(g)△H=(b+2c-a)kJ/mol | |
| D. | 当CO和H2的物质的量之比为1:2时,其完全燃烧生成CO2和H2O(l)时,放出Q kJ热量,则混合气中CO的物质的量为$\frac{Q}{b+2c}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 L浓度为0.5 mol/L 硫酸溶液中含有NA个氢离子 | |
| B. | 1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒 | |
| C. | 由14g CO中含有的原子数为NA | |
| D. | 在H2O2+Cl2═2HCl+O2反应中,每生成32 g氧气,转移电子数4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溶液中SO42-的方法是:先加入BaCl2溶液,再加盐酸 | |
| B. | 从溴水中提纯单质溴的方法是:先用CCl4萃取,分液后再蒸馏 | |
| C. | 硫化钠溶液中通入硫化氢气体不发生化学反应 | |
| D. | 除去CO2中少量HCl的方法是:将混合气体通过盛有饱和NaHSO3溶液的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
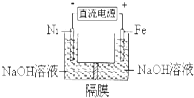
| A. | 铁是阳极,电极反应为Fe-6e-+4H2O═FeO42-+8H+ | |
| B. | 若隔膜为阴离子交换膜,则OH-自左向右移动 | |
| C. | 电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 | |
| D. | 每制得1mol Na2FeO4,理论上可以产生67.2L气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| B | C | D | |
| E |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com