
| 实验序号 | 试剂 | 现象 |
| I | 饱和Ag2SO4溶液 | 产生白色沉淀 |
| II | 0.2mol•L-1CuCl2溶液 | 溶液变绿,继续滴加产生棕黄色沉淀 |
| III | 0.1mol•L-1Al2(SO4)3溶液 | 开始无明显变化,继续滴加产生白色沉淀 |
分析 (1)亚硫酸为二元酸,具有还原性,可分解生成具有刺激性气味的二氧化硫;
(2)亚硫酸为二元弱酸,以第一步电离为主;
(3)①实验I中的白色沉淀是Ag2SO3.可说明Ag2SO3溶解度较小;
②实验II中的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-.说明铜离子和亚硫酸根离子发生氧化还原反应生成SO42-,溶液中含有氯离子;
③实验III中的白色沉淀中无SO42-,该白色沉淀既能溶于强酸,又能溶于强碱,说明含有氢氧化铝,还可使酸性KMnO4溶液褪色,说明含有还原性的SO32-.
解答 解:(1)亚硫酸为二元酸,具有还原性,可分解生成具有刺激性气味的二氧化硫,S为+4价,亚硫酸也具有氧化性,故答案为:abcd;
(2)亚硫酸为二元弱酸,以第一步电离为主,电离方程式为H2SO3?H++HSO3-,HSO3-?H++SO32-,故答案为:H2SO3?H++HSO3-,HSO3-?H++SO32-;
(3)①实验I中的白色沉淀是Ag2SO3.可说明Ag2SO3溶解度较小,反应的离子方程式为2Ag++SO32-=Ag2SO3↓,故答案为:2Ag++SO32-=Ag2SO3↓;
②实验II中的棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-.说明铜离子和亚硫酸根离子发生氧化还原反应生成SO42-,溶液中含有氯离子,检验方法为取少量滤液,用足量盐酸酸化后滴加氯化钡溶液,有白色沉淀生成,证明含SO42-;另取少量滤液,用足量硝酸酸化后滴加硝酸钡溶液,过滤,向所得滤液中滴加硝酸银溶液,有白色沉淀生成,证明含Cl-,
故答案为:SO42-、Cl-;取少量滤液,用足量盐酸酸化后滴加氯化钡溶液,有白色沉淀生成,证明含SO42-;另取少量滤液,用足量硝酸酸化后滴加硝酸钡溶液,过滤,向所得滤液中滴加硝酸银溶液,有白色沉淀生成,证明含Cl-;
③实验III中的白色沉淀中无SO42-,该白色沉淀既能溶于强酸,又能溶于强碱,说明含有氢氧化铝,还可使酸性KMnO4溶液褪色,说明含有还原性的SO32-,
故答案为:SO32-、OH-.
点评 本题考查性质实验的设计,为高考常见题型,题目难度较大,试题涉及物质组成、性质、离子方程式、离子的检验方法等知识,试题知识点较多,综合性较强,充分考查了学生灵活应用基础知识的能力.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水跟盐酸反应:OH-+H+→H2O | |
| B. | 铁与硝酸银溶液反应:Fe+Ag+→Fe2++Ag | |
| C. | 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+→Cu2++2H2O | |
| D. | 氢氧化钡跟稀硫酸反应:Ba2++OH-+H++SO42-→BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入3mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入3mL 5% H2O2溶液和3mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温、常压下,11.2升N2含有的分子数为0.5 NA | |
| B. | 标准状况下,22.4LH2和O2的混合气体所含的分子数为NA | |
| C. | 标准状况下,18g H2O的体积是22.4L | |
| D. | 1mol任何物质的体积在标准状况下都约是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
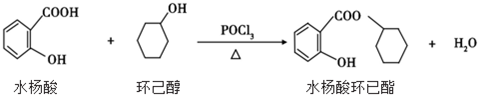
| A. | 水杨酸的核磁共振氢谱有 4 个吸收峰 | |
| B. | 水杨酸、环已醇和水杨酸环已酯都能与 FeCl3 溶液发生显色反应 | |
| C. | 1mol 水杨酸跟浓溴水反应时,最多消耗 2molBr2 | |
| D. | 1mol 水杨酸环已酯在 NaOH 溶液中水解时,最多消耗 3molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠固体 | B. | 少量锌粉 | C. | 硫酸钾溶液 | D. | 盐酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com