
| A、H2(g)的燃烧热为571.6 kJ?mol-1 | ||||||
| B、同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | ||||||
C、
| ||||||
| D、3H2(g)+CO2(g)=CH3OH(l)+H2O(l)△H=+135.9 kJ?mol-1 |
| 1 |
| 2 |
| 1 |
| 32 |


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
| A、NaCl=Na++Cl- |
| B、HClO?ClO-+H+ |
| C、NH3?H2O=NH4++OH- |
| D、NaOH=Na++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
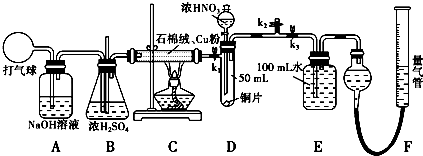
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Q1+Q2+Q3 |
| B、0.5Q3-Q2+2Q1 |
| C、0.5Q3+Q2-2Q1 |
| D、0.5(Q1+Q2+Q3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一组 | 加入0.5g水 | 很快产生火花 |
| 第二组 | 加入1g胆矾 | 约30s产生火花 |
| 第三组 | 加入1g无水硫酸铜 | 1min内没有明显现象 |
| A、水能加快铝和碘的反应 |
| B、第三组铝和硫酸铜发生了置换反应 |
| C、第一组和第二组实验中均放出热量 |
| D、第一组实验中铝和碘发生反应生成了AlI3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com