
分析 等物质的量CO和CO2,设物质的量均为1mol,结合ρ=$\frac{M}{Vm}$、n=$\frac{m}{M}$、V=nVm及分子构成计算.
解答 解:等物质的量CO和CO2,设物质的量均为1mol,其中碳原子数之比为1mol:1mol=1:1,氧原子数之比为1mol:1mol×2=1:2,同温同压下密度之比等于摩尔质量之比,为28:44=7:11;等质量的CO和CO2其中碳原子数之比为$\frac{m}{28}$:$\frac{m}{44}$=11:7,在标准状况下的体积之比为$\frac{m}{28}$×Vm:$\frac{m}{44}$×Vm=11:7,
故答案为:1:1;1:2;7:11;11:7;11:7.
点评 本题考查物质的量的计算,为高频考点,把握物质的构成、物质的量与质量和体积的关系为解答的关键,侧重分析与计算能力的考查,注意物质的构成,题目难度不大.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
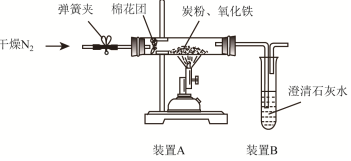
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其原子核内有8个中子 | B. | 是C60的同素异形体 | ||
| C. | 是14N的同素异形体 | D. | 与C60互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2═Mg2++2Cl- | B. | Fe2(SO4)3═2Fe3++3SO42- | ||
| C. | NaHCO3═Na++H++CO32- | D. | KHSO4═K++H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨 | B. | 二氧化锰 | C. | 汞 | D. | 锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2FeCl2+Cl2═2FeCl3,反应中氧化产物和还原产物质量比为1:1 | |
| B. | 根据反应I2+SO2+2H2O═H2SO4+2HI,说明还原性SO2<HI | |
| C. | 8NH3+3Cl2═6NH4Cl+N2中氧化剂和还原剂物质的量之比为3:8 | |
| D. | KClO3+6HCl═3Cl2+KCl+3H2O,每生成3molCl2,转移电子6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓硝酸与浓盐酸一样,在空气中出现白雾 | |
| B. | 硝酸见光分解和受热分解产物相同,都是NO2、O2、H2O | |
| C. | NO2和水反应有HNO3生成,所以NO2是硝酐 | |
| D. | 硝酸与金属反应,既表现出氧化性,又表现出酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com