
| A. | C2H2分子内含有极性键,但C2H2分子是非极性分子 | |
| B. | 分子晶体、原子晶体一定含有共价键,离子晶体一定含有离子键 | |
| C. | 气态氢化物的稳定性随着其相对分子量的增大而增强 | |
| D. | 某非金属元素从游离态变成化合态时,该元素一定被还原 |
分析 A.C2H2为直线形分子,结构对称,正负电荷中心重叠;
B.单原子分子中没有共价键;
C.气态氢化物的稳定性与共价键的强弱有关;
D.根据元素的化合价变化判断.
解答 解:A.C2H2为直线形分子,结构对称,正负电荷中心重叠,分子不显电性,所以属于非极性分子,故A正确;
B.单原子分子中没有共价键,如稀有气体分子中没有共价键,所以分子晶体中不一定含有共价键,故B错误;
C.气态氢化物的稳定性与共价键的强弱有关,气态氢化物的稳定性与相对分子量无关,故C错误;
D.某非金属元素从游离态变成化合态时,该元素的化合价可能升高也可能降低,所以该元素可能被氧化,也可能被还原,故D错误.
故选A.
点评 本题考查了极性键、极性分子、化学键、氧化还原反应等知识点,难度不大,易错选项是B,注意稀有气体是单原子分子,只存在分子间作用力,不存在化学键.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:解答题
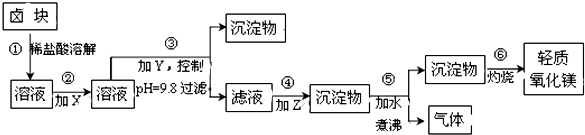
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (Ⅰ) W,X,Y,Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻; X,Y位于同一主族,它们能组成YX2,YX3两种常见化合物;W元素的氢化物与Z元素的氢化物反应生成盐.请回答下列问题:
(Ⅰ) W,X,Y,Z四种短周期元素,原子序数依次增大,在周期表中W与X相邻、Y与Z相邻; X,Y位于同一主族,它们能组成YX2,YX3两种常见化合物;W元素的氢化物与Z元素的氢化物反应生成盐.请回答下列问题: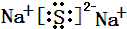 .(用元素符号表示)
.(用元素符号表示)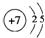 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CHCl3是三角锥形 | B. | AB2是V形,其A可能为sp2杂化 | ||
| C. | 二氧化硅是sp杂化,是非极性分子 | D. | NH4+是平面四边形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键存在于分子之间,也存在于分子之内 | |
| B. | 对于分子,其范德华力只随着相对分子质量的增大而增大 | |
| C. | NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子 | |
| D. | 冰熔化时只破坏分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 试管1 | 17.5 | 34.9 | 50.1 | 60.3 | 70.4 | 80.2 | 84.9 | 85.2 | 85.4 |
| 试管2 | 21.7 | 41.2 | 57.5 | 70.8 | 81.3 | 84.9 | 85.3 | 85.4 | 85.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com