
 请回答下列问题:
请回答下列问题: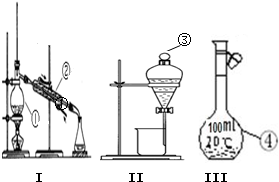
| 1000×1.84×98% |
| 98 |
| 1mol/L×0.5L |
| 18.4mol/L |


科目:高中化学 来源:不详 题型:单选题
| A.448mL26.2g | B.500mL29.3g |
| C.1000mL29.3g | D.450mL26.2g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
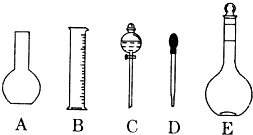
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.取100 mL 5mol/LH2SO4,加入400mL水 |
| B.取200 mL 5mol/LHCl,加水稀释至500mL |
| C.取100mL 5mol/LH2SO4,加水稀释至500mL |
| D.取100mL 5mol/LHNO3,加水稀释至500mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸稀释后,没有冷却直接转移到容量瓶中 |
| B.定容时俯视刻度线 |
| C.转移过程中没有洗涤小烧杯 |
| D.容量瓶洗净后,没有干燥 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.01mol/L | B.0.1mol/L | C.0.05mol/L | D.0.04mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com