
| 编号 | 实验操作 | 现象 |
| 步骤1 | 向酸化的FeSO4溶液中加入KSCN溶液 | 溶液几乎无色 |
| 步骤2 | 取步骤1中反应液少量,加入少量PbO2,充分反应 | 溶液变红 |
| 步骤3 | 取步骤2中反应液少量,加入足量Pb,充分反应 | 红色褪去 |
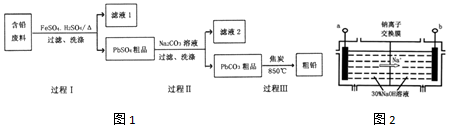
分析 以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)为原料,制备粗铅,含铅废料加入硫酸亚铁、稀硫酸加热反应过滤得到PbSO4粗品,加入碳酸钠溶液过滤得到PbCO3粗品,向其中加入焦炭在850℃生成铅,
(1)根据题给化学工艺流程知,过程Ⅰ中,在Fe2+催化下,Pb、PbO2和H2SO4反应生成PbSO4和水;
(2)①催化剂通过参加反应,改变反应历程,降低反应的活化能,加快化学反应速率,而本身的质量和化学性质反应前后保持不变.根据题给信息知反应i中Fe2+被PbO2氧化为Fe3+,则反应ii中Fe3+被Pb还原为Fe2+,据此书写离子方程式;
②KSCN溶液与铁离子显红色:向酸化的亚铁离子中加入PbO2证明发生反应i,则再加入Pb证明发生反应ii,实验方案为取红色溶液少量,加入过量Pb,充分反应后,红色褪去;
(3)因为Ksp(PbSO4)=1.6×10-5,Ksp (PbCO3)=3.3×10-14,c(SO42-)=1.6mol•L-1,c(CO32-)=0.1mol•L-1,PbCO3中:c(Pb2+)=$\frac{Ksp(PbC{O}_{3})}{c(C{{O}_{3}}^{2-})}$=3.3×10-13,;PbSO4中:Q=c(Pb2+)×c(SO42-)=3.3×10-13×1.6=5.28×10-13<Ksp(PbSO4),说明PbSO4在母液中未饱和,即PbCO3中不混有PbSO4;
(4)①根据钠离子向阴极移动知,a为阴极,与电源负极相连;
②电解过程中,PbO2在阴极得电子,电极反应式为PbO2+4e-+2H2O=Pb+4OH-;
③钠离子交换膜只允许钠离子通过,阻止HPbO2-进入阳极室被氧化,从而提高Pb元素的利用率.
解答 解:(1)根据题给化学工艺流程知,过程Ⅰ中,在催化下,Pb、PbO2和H2SO4反应生成PbSO4和水,化学方程式为:Pb+PbO2+2H2SO4$\frac{\underline{\;Fe_{2}+\;}}{\;}$2PbSO4+2H2O;
故答案为:Pb+PbO2+2H2SO4$\frac{\underline{\;Fe_{2}+\;}}{\;}$2PbSO4+2H2O;
(2)①催化剂通过参加反应,改变反应历程,降低反应的活化能,加快化学反应速率,而本身的质量和化学性质反应前后保持不变.根据题给信息知反应i中Fe2+被PbO2氧化为Fe3+,则反应ii中Fe3+被Pb还原为Fe2+,离子方程式为:2Fe3++Pb+SO42-═PbSO4+2Fe2+;
故答案为:2Fe3++Pb+SO42-=PbSO4+2Fe2+;
②步骤1:向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,
步骤2:取步骤1中反应液少量,再加入少量PbO2,溶液变红,亚铁离子被氧化为铁离子,
步骤3:取步骤2中红色溶液少量,溶液中存在平衡,Fe3++3SCN-=Fe(SCN)3,加入过量Pb,和平衡状态下铁离子反应生成亚铁离子,平衡逆向进行充分反应后,红色褪去;
故答案为:
| 编号 | 实验操作 | 现象 |
| 步骤2 | 取步骤1中反应液少量,加入少量PbO2,充分反应 | 溶液变红 |
| 步骤3 | 取步骤2中反应液少量,加入足量Pb,充分反应 | 红色褪去 |
点评 本题考查未知反应书写、溶度积、电化学及基础实验问题,是高考常见题型,向考生展示运用化学知识解决生产生活中的实际问题,题目难度较大.


科目:高中化学 来源: 题型:解答题
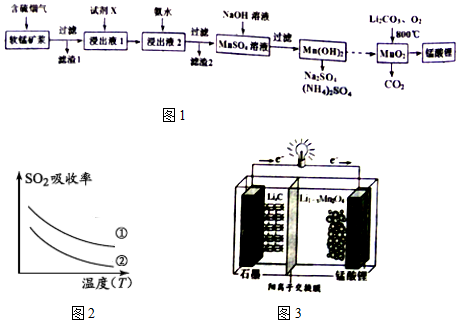
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
| 实验序号 | SO2浓度(g•m-3) | 烟气流速(mL•min-1) |
| ① | 4.1 | 55 |
| ② | 4.1 | 96 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 聚乙烯、植物油都是混合物,都能使溴的四氯化碳溶液褪色 | |
| B. | 苯、溴水、铁粉混合制成溴苯 | |
| C. | 沸点:戊烷>丁烷>乙烷 | |
| D. | 由丙烯加溴制1,2-二溴丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 投入足量漂白粉后的溶液中:Fe2+、H+、Cl-、SO42- | |
| B. | 0.1mol/LFeCl3溶液中:Na+、Ba2+、NO3-、SCN- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-13mol/L的溶液中:NH4+、Ca2+、Cl、NO3- | |
| D. | 水电离的c(OH-)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g CO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L 0.5mol/L亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 0.5mol CH5+中含有的电子数目为5NA | |
| D. | 常温下,1L 0.5 mol/L Ba(OH)2溶液中水电离的OH-个数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A | 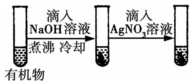 | 最后试管中出现白色沉淀 | 有机物中含 有氯原子 |
| B | 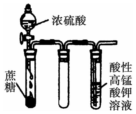 | 酸性高锰酸钾溶液褪色 | 浓硫酸有 吸水性 |
| C | 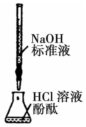 | 最后一滴标准液使酚酞由无色变为浅红色,且30s内不褪色 | 滴定达到 终点 |
| D | 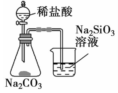 | Na2SiO3溶液变浑浊 | 非金属性 Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
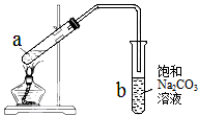
| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象 | |
| C. | 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动 | |
| D. | 饱和Na2CO3溶液可以降低乙酸乙酯的溶解度,并吸收蒸出的乙酸和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
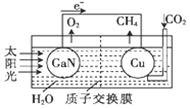 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 电池工作时,是将太阳能转化为电能 | |
| B. | 铜电极为正极,电极反应式为:CO2+8e-+8H+═CH4+2H2O | |
| C. | 电池内部H+透过质子交换膜从左向右移动 | |
| D. | 为提高该人工光合系统的工作效率,可向装置中加入少量硝酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com