
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4[来源: |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
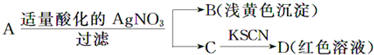
| A.D溶液中存在Fe(SCN)3 | B.滤液中有Fe3+ |
| C.B为AgBr | D.A一定为无氧酸盐FeBr2 |
查看答案和解析>>
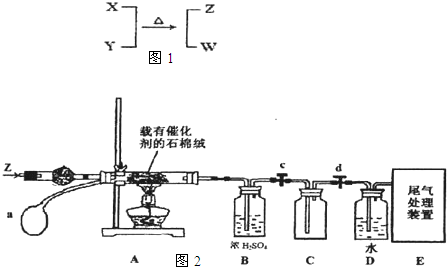
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| T/K | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.所有的电子在同一区域里运动 |
| B.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动 |
| C.处于最低能量的原子叫基态原子 |
| D.同一原子中,1s、2s、3s所能容纳的电子数越来越多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 )是人体必需的微量元素,在元素周期表中的位置如下图。下列关于硒元素的叙述正确的是
)是人体必需的微量元素,在元素周期表中的位置如下图。下列关于硒元素的叙述正确的是| O | |
| S | |
| Se | Br |
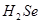 比
比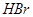 稳定
稳定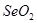
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com