
A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大。短周期元素中C的原子半径最大,B、E同族,E的最外层电子数是电子层数的2倍,A的最高价氧化物水化物为H2AO3,D是地壳中含量最高的金属元素。
(1)A的元素符号是 ,C2B2的电子式为 。
(2)B、C、D、F的离子半径由大到小的顺序是 (用离子符号表示)。
(3)E和F相比,非金属性强的是 (用元素符号表示),下列事实能证明这一结论的是 (用符号填空)。
①常温下E的单质呈固态,F的单质呈气态 ②气态氢化物的稳定性:F>E ③E和F形成的化合物中,E显正价 ④F单质能与E的氢化物发生置换反应 ⑤E和F的氧化物的水化物的酸性强弱 ⑥气态氢化物的还原性:E>F
(4)把CDB2溶液蒸干所得的固体物质为 (填化学式)。
(5)C和F可组成化合物甲,用惰性电极电解甲的水溶液,电解的化学方程式为 。
(6)A、B、C三种元素组成的常见化合物乙的溶液中,离子浓度由大到小的顺序为 ,pH=10的乙溶液中由水电离产生的c(OH-)= mol·L-1。
(1)C 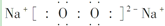
(2)Cl->O2->Na+>Al3+
(3)Cl ②③④⑥
(4)NaAlO2
(5)2NaCl+2H2O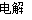 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(6)c(Na+)>c(CO)>c(OH-)>c(HCO)>c(H+) 10-4
【解析】根据提供信息,A为C,B为O,C为Na,D为Al,E为S,F为Cl。(2)O2-、Na+、Al3+核外两个电子层,Cl-核外三个电子层,根据具有相同电子层结构的粒子,核电荷数越大,粒子半径越小,则离子半径大小为Cl->O2->Na+>Al3+。(3)S、Cl同周期,非金属性:Cl>S。①常温下单质的状态不能证明非金属性强弱;②气态氢化物越稳定,非金属性越强;③元素形成的化合物中显负价,说明得电子能力强,从而证明非金属性强;④非金属性强的元素对应的单质氧化性更强;⑤根据元素最高价氧化物的水化物酸性证明非金属性强弱,题中未标明最高价,不能证明;⑥气态氢化物还原性越弱,非金属性越强。
(6)Na2CO3溶液中由于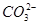 水解溶液显碱性,pH=10的Na2CO3溶液中水的电离得到促进,由水电离出的c(OH-)=10-4mol/L。
水解溶液显碱性,pH=10的Na2CO3溶液中水的电离得到促进,由水电离出的c(OH-)=10-4mol/L。


科目:高中化学 来源:2014高考名师推荐化学氧化还原反应方程式的配平及相关计算(解析版) 题型:选择题
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和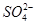 )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
A.9.0 L B.13.5 L C.15.7 L D.16.8 L
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学无机物性质及应用(非金属)(解析版) 题型:选择题
下列说法不正确的是
A.二氧化硫不能用于食品增白
B.Cl2溶于氢氧化钠溶液可以制取84消毒液
C.SiO2不溶于强酸,因而它可以保存在玻璃试剂中
D.NO遇空气变成红棕色
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学无机物性质及应用(金属)(解析版) 题型:选择题
下列关于物质的用途或变化,说法正确的是
A.Al2O3熔点很高,可用作耐火材料
B.高纯度的硅单质用于制作光导纤维
C.铝热反应是炼铁最常用的方法
D.N2与O2在放电条件下直接化合生成NO2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学微粒的组成、结构及性质(解析版) 题型:选择题
两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有
A.1对 B.2对 C.3对 D.4对
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学弱电解电离(解析版) 题型:选择题
H2S水溶液中存在电离平衡H2S H++HS-和HS-
H++HS-和HS- H++S2-若向H2S溶液中
H++S2-若向H2S溶液中
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.滴加新制氯水,平衡向左移动,溶液pH值减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学常见有机物性质与结构(解析版) 题型:选择题
下列说法正确的是
A.油脂、淀粉、蔗糖和葡萄糖在一定条件都能发生水解反应
B.蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N四种元素
C.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O
D.根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学实验专题(解析版) 题型:填空题
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
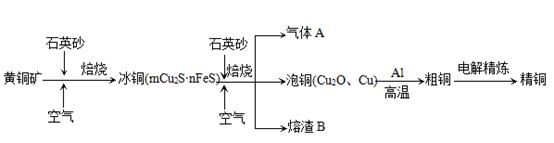
(1)气体A中的大气污染物可选用下列试剂中的_______
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填离子符号),检验溶液中还存在Fe2+的方法是 (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com