
【题目】可逆反应X2+3Y2![]() 2Z2在反应过程中,反应速率(v)与时间(t)关系曲线如图所示,下列叙述不正确的
2Z2在反应过程中,反应速率(v)与时间(t)关系曲线如图所示,下列叙述不正确的

A.t1时,正反应速率大于逆反应速率
B.t1~t2,逆反应速率逐渐减小
C.t2时,正反应速率与逆反应速率相等
D.t2~t3,各物质的浓度不再发生变化
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列的物理量不再发生变化时,表明反应A(固)+2B(气)![]() C(气)+D(气)已达到平衡状态的是( )
C(气)+D(气)已达到平衡状态的是( )
A. 混合气体的压强 B. 混合气体的密度
C. 气体的总物质的量 D. A的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示物质A~F之间的转化关系,其中A为淡黄色固体物质,B、C为无色溶液,D为气体,E、F为白色沉淀。请填写下列各空:
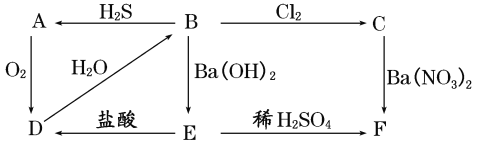
(1)写出各物质的化学式:
A为______,B为_____,C为_____,D为_____,E为_____,F为______。
(2)写出下列反应的化学方程式:
B→A:________________________。
B→C:___________________________。
(3)写出C→F的离子方程式:___________________。
(4)在A~F六种物质中,既有氧化性又有还原性的是(填字母代号)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液说法正确的是
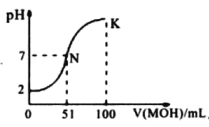
A. 1. 0mol/L NH4HCO3溶液pH=8.0,由此可知Ka1(H2CO3)>Kb (NH3·H2O)>Kaa2(H2 CO3)
B. 向氨水中加入NH4C1固体,溶液中c(NH3·H2O )·c(H+)/c(NH4+)增大
C. 向CH3 COONa溶液中滴加硫酸至中性时,c(SO42-)<c(CH3COOH)
D. 图中曲线可以表示向100mL0.01mol/LCH3COOH溶液中逐滴加入0.02 mol/LNaOH溶液的pH变化情况(溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。

当溶液pH约为4时,停止反应,在20℃左右静置结晶。生成Na2S2O5的化学方程式为
2NaHSO3===Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是______________________________。
(3)析出固体的反应液经减压抽滤、洗涤、25℃~30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、________________和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是______。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将红热的固体单质M放入浓硝酸中,剧烈反应,产生混合气体A,A在常温下不与空气接触时,发生如图所示的变化。

(1)混合气体A的主要成分是____________。
(2)气体B为__________,蓝色溶液D为____________。
(3)单质M与浓硝酸反应的化学方程式是____________________________。
(4)单质C与稀硝酸反应的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知空气-锌电池的电极反应为:
锌粒:Zn + 2OHˉ— 2eˉ= ZnO + H2O
石墨:O2 + H2 + 2eˉ = 2OHˉ。
根据判断,锌片
A.正极,并被还原 B.正极,并被氧化
C.负极,并被还原 D.负极,并被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加___,该过程的现象为:___
(2)步骤②加入过量H2O2的目的:____。
(3)步骤②③中反应的离子方程式:②_____、③____。
(4)步骤④中一系列处理的操作步骤:过滤、___、灼烧、____、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量___g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com